KirURGy
domingo, 5 de março de 2017
Capítulo 14: Separação Posterior de Componentes
Este não é bem um tema de urgência, mas achei interessante falar sobre ele, até porque será tema de um curso pré-congresso do XXXVII Congresso Nacional de Cirurgia e este texto pode servir de apoio à "aula" que aí vou apresentar.
No disease of the human body, belonging to the province of the surgeon, requires in its treatment a better combination of accurate anatomical knowledge, with surgical skill, than hernia in all its variety.
Astley Paston Cooper, 1768-1841
Na actualidade, a hérnia incisional representa um problema de saúde importante, complicando entre 11 a 23% de todas as laparotomias. Pior ainda, é o facto de que muitas delas irão recidivar. Entre 25 a 54% das hérnias reparadas sem prótese irão recidivar no prazo de um ano, e até 32% se forem reparadas com algum tipo de prótese.
A história natural da hérnia incisional tem também sofrido modificações ao longo do tempo. A emergência de técnicas cirúrgicas baseadas na cirurgia de controlo de danos, levou ao aparecimento de doentes em que o encerramento primário é impossível, originando um conjunto hérnias ventrais programadas que representam um sério problema cirúrgico.
Apesar do aparecimento de redes e próteses cada vez maiores e mais seguras, permitindo a reparação por via laparoscópica de grandes defeitos, alguns autores sempre entenderam que os grandes defeitos da parede abdominal necessitam de uma reparação mais fisiológica. Nesse sentido, a reparação de Rives-Stoppa terá sido a primeira a surgir, nos anos 1970, aproveitando o espaço retromuscular, posterior ao grande recto abdominal, para reforçar com prótese a reparação da linha média. Em 1990, Oscar Ramirez descreveu a separação anterior de componentes, aliando a secção do grande obliquo ao longo da linha semilunar à separação e abertura do espaço entre o grande e o pequeno obliquo. O conceito baseava-se na necessidade de produzir um avanço mio-fascial com aproximação das estruturas à linha média, permitindo uma reparação funcional da parede abdominal. Porém, a técnica de Rives-Stoppa não permite a sua aplicação quando o defeito é muito grande e a técnica de Ramirez obriga a um descolamento cutâneo extenso, com secção dos vasos nutritivos, produzindo, com frequência, a necrose do retalho.
 |
| Laparoplastia de Rives-Stoppa Imagem: https://es.slideshare.net/ivojvodic2000/cirugia-de-eventraciones-gigantes |
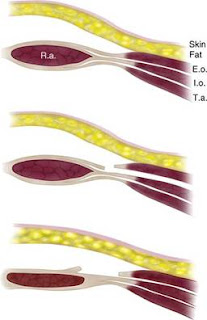 |
| Separação anterior de componentes segundo Ramirez Imagem: http://drkevinbrenner.com/uncategorized/reconstruction-massive-abdominal-hernias/ |
Como sabemos, as hérnias incisionais apresentam, frequentemente, defeitos volumosos ou múltiplos. O "bulging" que produzem na parede abdominal pode ser tão importante que, além do defeito funcional, é um estorvo fisico para os doentes, obrigando-os a usar algum tipo de contenção. A colocação de uma prótese sub-peritoneal, como se faz em laparoscopia, pode evitar o movimento visceral e o encarceramento, mas o defeito funcional e fisico permanecem. Não me parece que seja uma solução adequada, sobretudo para defeitos de grande volume. É necessária uma reparação da linha branca... Em 2004 a American Hernia Society considerou as técnicas de avanço mio-fascial como gold standard no tratamento de hérnias incisionais por via aberta.
Nos anos 2010 começou a surgir uma nova técnica, utilizada de forma um pouco inconsistente por vários autores, mas definida e publicada por Michael Rosen em 2012. Trata-se da separação posterior de componentes. A Separação Posterior de Componentes vem afirmar-se como um método alternativo para reparação de grandes defeitos da parede abdominal, podendo ser usada em quase todos os casos. Preserva a inervação do músculo grande recto e a vascularização muscular e da pele e tecido celular subcutâneo, reconstruindo a linha branca, contribuindo assim quer para uma reparação funcional, quer para redução das complicações ligadas à necrose do retalho.
A técnica pode resumir-se nos seguintes passos:
1. Adesiólise: Após a abertura ampla da cavidade abdominal, sem remoção de pele ou de saco (irão perceber porquê), as aderências entre as ansas e a parede devem ser cuidadosamente desfeitas. Além de permitir uma melhor aproximação à linha média do saco visceral, evita a lesão das ansas durante o descolamento do peritoneu/fascia transversalis do músculo transverso do abdomen.
2. Abertura da bainha posterior do recto: Esta manobra é iniciada, em regra, junto ao umbigo e cerca de 5 mm dentro e posterior ao bordo do defeito herniário. A secção levará à exposição do bordo medial do músculo grande recto do abdómen e será alargada em sentido cranial e caudal.
3. Desenvolvimento de plano retromuscular: Descolamento do músculo grande recto de abdomen da aponevrose da bainha posterior. Esta dissecção deve ser feita com o cuidado para preservação do vasos epigástricos que percorrem o músculo longitudinalmente e o rolo nervoso que penetra no grande recto do abdomen atravessando a bainha posterior. A preservação destas estruturas é fundamental para os bons resultados da técnica.
4. Abertura da bainha posterior do grande recto e secção do músculo transverso do abdómen: Iniciando na sua extremidade superior, onde o músculo transverso se estende mais para dentro, a bainha posterior é seccionada, acedendo ao músculo transverso que é seccionado em conjunto. Nesta manobra há que ter cuidado com os componentes vasculo-nervosos, pelo que deve efectuar-se ligeiramente medial à linha semilunar, e até à fascia endo-abdominal, que não deve ultrapassar-se. Deve colocar-se o plano de dissecção posterior ao músculo transverso e entre este e a fascia endo-abdominal.
 |
| Abertura da bainha posterior do grande recto abdominal Imagem: Atlas of Abdominal Wall Reconstruction. Rosen MJ ed. Philadelphia, PA; Elsevier; 2011. |
5. Desenvolvimento do espaço entre o transverso do abdómen e a fascia endo-abdominal bilateralmente: Este descolamento é executado por dissecção romba. Trata-se de um espaço avascular que pode ser estendido, lateralmente até ao quadrado dos lombos, para acomodar a prótese. Qualquer orifício no peritoneu deve ser reparado. Se não for possível o seu encerramento primário, pode usar-se o epíploon ou um pedaço de rede absorvível (Vycril).
6. Desenvolvimento do espaço sub-xifoideu e retro-púbico: Continuando o descolamento a nível superior e inferior, abrem-se os espaços de Retzius, em baixo, expondo o ligamento de Cooper, e o apêndice xifóide, em cima. É importante que este espaço seja amplo para acomodar a prótese, que deverá exceder o defeito da hérnia. A distância de sobreposição da prótese não é consensual, mas o valor mais referido é de 8 a 10 cm.
7. Encerramento na linha média do "envelope" visceral: O "envelope" constituído pela fascia endo-abdominal e peritoneu, reforçado na linha média pela bainha posterior dos rectos, é aproximada na linha média e suturada. Raras vezes não será possível encerrar esse defeito. Se assim for, poderão usar-se restos do saco herniário para o efeito.
8. Colocação da rede no espaço pré-peritoneal: A rede deve ser colocada neste espaço dissecado, com as medidas ajustadas ao tamanho do defeito. A fixação deverá ser efectuada com fio não absorvível, com 2 pontos a nível do ligamento de Cooper (um em cada lado), dois pontos sub-xifoideus e 4 pontos de cada lado, trans-aponevróticos. Este últimos poderão necessitar pequenas incisões cutâneas para poder dar os nós, após passagem com agulha de Reverdin através da parede lateral músculo-aponevrótica.
9. Encerramento da linha média: O bordo interno da bainha dos rectos é aproximada com fio não absorvível após a colocação de drenagem aspirativa na loca onde repousa a prótese e sobre esta. Habitualmente utilizam-se dois drenos com aspiração activa, um em cada lado. Por vezes, a aproximação da linha média não é possível, pelo que o defeito terá de ser completado por prótese, também. A escolha recai sobre uma prótese de polipropileno simples, que deverá ser coberta com tecido celular subcutâneo durante o encerramento da pele. Só agora iremos verificar se é necessário remover pele e qual a quantidade a remover para não ficar "sem pano".
Aconselho a não operar doentes obesos ou fumadores. Os resultados são maus para estes doentes, com todas as técnicas. Assim, um doente com IMC superior a 40 deve ser aconselhado a emagrecer. Um doente fumador deveria para de fumar 4 semanas antes de ser operado. É evidente que estes são objectivos algo irreais, mas operar um doente com uma grande hérnia incisional que mantém hábitos tabágicos ou com IMC elevado é arriscar não só uma recorrência, mas complicações pós-operatórias graves.
A prótese a usar deve ser não reabsorvível. Uma vez que é colocado num espaço que não estará em contacto com vísceras, a utilização de uma malha de polipropileno simples parece-me adequada. Na presença de infecção ou contaminação, como é o caso em que se tem de manipular estomias, a utilização de uma prótese biológica pode estar indicada. Ultimamente tenho utilizado uma prótese auto-colante, sem fixação (Adhesix Bard). Os resultados são bons, aparentemente, e permite reduzir um pouco o tempo operatório, que anda à volta das 4 horas... em média.
Uma nota sobre o período pós-operatório. A analgesia é de vital importância e a utilização de epidural é aconselhada de forma sistemática. O início precoce, e mesmo pré-operatório, de cinesiterapia respiratória é crucial. Esta técnica cirúrgica cria um espartilho que pode perturbar a função respiratória e este facto deve ser previsto. A elevação da pressão de pico inspiratório durante o encerramento da aponevrose pode indicar a necessidade de permanência do doente sob ventilação assistida e ser desmamado com mais tempo, em UCIP, no decurso de 24 a 48 horas.
Os resultados desta técnica são bons. Segundo os estudos do próprios Michael Rosen, a taxa de recidiva anda à volta dos 5%. São resultados muito encorajadores, mas o que sobressai mais é a redução da taxa de infecções pós-cirúrgicas relativamente às outras técnicas de avanço mio-fascial, particularmente à técnica de Ramirez. Esta última, em vários estudos, reporta-se uma taxa de infecção entre 26 e 42%, condicionada pela isquémia dos retalhos cutâneos. Num dos seus primeiros trabalhos, após 42 hernioplastias, Michael Rosen verificou uma taxa de 7% de infecções da ferida operatória grave. Num estudo comparativo entre a técnica de separação anterior e a posterior de componentes, o mesmo autor reporta taxas de 48,2% e 25,5% de complicações da ferida operatória, respectivamente.
Em conclusão: trata-se de situações complexas que necessitam, para a sua abordagem, uma técnica que seja inteligente e resolva os problemas do doente. Isso significa que, mais do que tapar o orifício, é preciso oferecer ao doente uma reparação que restaure a funcionalidade da parede abdominal. Isso só é possível através das técnicas de aproximação mio-fascial com reconstrução da linha média, reforçada por uma prótese. No caso da Separação Posterior de Componentes, a prótese é colocada num espaço virtual, pré-peritoneal, longe do contacto com as vísceras e longe da superfície.
Are you sure you are the best person for the job?
Francis D. Moore
sábado, 4 de fevereiro de 2017
Capítulo 13: Isquémia mesentérica aguda
A isquémia mesentérica aguda foi alvo recente de uma publicação de guidelines em que tive o prazer de participar. Podem aceder ao artigo completo em http://link.springer.com/article/10.1007/s00068-016-0634-0.
Vou discutir neste texto apenas alguns aspectos mais práticos.
“Occlusion of the mesenteric vessels is regarded as one of those conditions in which the diagnosis is impossible, the prognosis hopeless, and the treatment almost useless”.
Esta frase, proferida por Cokkinis há mais de 70 anos atrás, revela um pessimismo que ainda hoje prevalece, quando falamos de isquémia mesentérica aguda (AMI). Para esta opinião contribui o mau prognóstico destes doentes, que se tem mantido ao longo de décadas, apesar da evolução técnica e cientifica da Medicina, em geral e da Cirurgia em particular.
A AMI constitui menos de 1% do total dos quadros de abdómen agudo que se apresentam nos Serviços de Urgência, mas cerca de 10% se os doentes tiverem idade superior a 70 anos. A mortalidade é elevada, entre 60 a 80%, sobretudo devido ao atraso diagnóstico.
A AMI pode ser dividida em 4 classes distintas:
- EAMI - embólica, a mais frequente, com origem habitual num êmbolo formado no coração.
- TAMI - trombótica, resultante da trombose de uma placa aterosclerótica na artéria mesentérica, habitualmente na sua origem.
Estas duas classes podem ser classificadas como AMI arterial oclusiva.
- VAMI - a trombose venosa, habitual numa população mais jovem e associada, frequentemente, a discrasias da coagulação.
- NOMI - a AMI não oclusiva, típica dos doentes críticos, habitualmente internados em Unidades de Cuidados Intensivos.
A doença arterial oclusiva é, de longe a mais comum. Os doentes são habitualmente idosos e portadores de patologia cardiovascular prévia, por vezes bem conhecida. A presença de arritmia cardíaca, principalmente fibrilhação auricular, sugere uma origem embólica. O inicio súbito da dor seguido de um intervalo livre de dor de duração variável (6 a 12 horas) é muito característico da oclusão embólica. A doença oclusiva trombótica tem uma apresentação mais insidiosa e por vezes, precedida de sintomas típicos de angor abdominal.
A doença venosa surge num contexto distinto. Os doentes são mais jovens, por vezes na década de 40. A associação com situações pré-trombóticas é muito frequente e entre estas o factor V de Leyden é o mais vezes encontrado. No entanto, não é de descartar a possibilidade de síndrome paraneoplásica, sobretudo de neoplasias primitivas do fígado e do pâncreas. As queixas são inespecíficas e com frequência de longa duração (vários dias ou semanas) e a sua evolução depende da extensão de delgado envolvido.
A doença não oclusiva é característica de doentes críticos. Doentes com sépsis, disfunção orgânica múltipla ou sob aminas são os mais típicos. Hemodiálise e pós-operatório de cirurgia cardíaca são outras condições que podem surgir associadas. Com o doente ventilado e entubado, as queixas clínicas são de pouco valor para levantar suspeita. Por vezes são o aparecimento súbito de distensão abdominal ou o agravamento dos parâmetros inflamatórios os primeiros indicadores da possibilidade de NOMI.
O primeiro passo para chegar ao diagnóstico é, efectivamente, a suspeita. Pensar na possibilidade de AMI é imprescindível para iniciar todo a investigação que leva a um diagnóstico precoce e a uma possibilidade de tratamento. Neste contexto, a suspeita pode ser, também, o melhor factor de bom prognóstico a favor do doente. Na presença de um doente com queixas abdominais inespecíficas, com idade e patologia associada favorável, a AMI deve fazer parte do diagnóstico diferencial inicial. O atraso diagnóstico é factor de prognóstico que mais influencia a sobrevida.
A suspeita deve levar à realização imediata de uma angioTC abdominal.
São várias as questões que se colocam relativamente à realização deste exame, porém, é apenas com ele que se podem tomar decisões relativas à subsequente atitude terapêutica. A presença de um doente com alguma instabilidade, por vezes com lesão renal aguda ou sem jejum, pode atrasar a realização da TC. No entanto, esta é uma das circunstâncias em que deverá ser realizada com a maior brevidade, sobretudo no doente que se apresenta com um quadro clínico sugestivo (dor abdominal, idade superior a 70 anos, patologia cardíaca...). Não existe nenhum outro meio diagnóstico que nos possa fornecer os dados que uma TC bem efectuada fornece. Já foram pesquisados imensos marcadores biológicos (e nós continuamos a procurar respostas na LDH, d-dimeros e lactatos, certo?) mas nenhum deles é sensível o suficiente para produzir alterações que nos conduzam ao diagnóstico em tempo útil.
Depois de conseguido um diagnóstico adequado, o doente necessita de uma ressuscitação adequada que passa pela administração de fluidos (cristalóides, quase sempre), correcção da acidose, administração de antibiótico de largo espectro e anticoagulação sistémica. A maioria destes doentes terão ser submetidos a algum tipo de intervenção para desobstrução vascular. Excluem-se os casos de trombose venosa, em que a anticoagulação pode ser suficiente e os doentes com NOMI...
Actualmente, no tratamento da doença oclusiva, podemos considerar que o Gold Standard é a angiografia e os procedimentos por via percutânea. É possível, por via endovascular, reparar estenoses da artéria mesentérica superior e mesmo remover trombos e êmbolos no seu interior. Há que salvaguardar os casos em que há sinais de irritação peritoneal ou outra evidência da existência de sofrimento irreversível das ansas intestinais, indicando, formalmente, a sua ressecção. Nestes casos, além do procedimento de revascularização, é necessária a laparotomia para remoção do tecido necrosado.
Porém, a logística necessária para estes procedimentos não está disponível em todos os Hospitais e, nestes casos, tempo é dinheiro. Assim, poderá ser necessária a abordagem primária cirúrgica para restabelecimento da continuidade vascular. Em casos de ausência de sinais que indiquem uma exploração urgente por peritonite, é aceitável a transferência do doente para um Hospital com meios imagiológicos de intervenção, caso a transferência se possa fazer de forma expedita. Nos restante casos, o Cirurgião Geral ou o Cirurgião Vascular, terão de abordar o doente com uma estratégia de revascularização em mente, além da possibilidade de ressecção intestinal. No caso da EAMI, a embolectomia da artéria mesentérica superior é, em regra, suficiente. Após um controlo proximal e distal da artéria, com dissecção cuidada, a "Fogartização" proximal e distal com verificação de retoma de fluxo é a manobra adequada. Classicamente, nestas circunstâncias, a arteriotomia deve ser transversal, permitindo o acesso ao lúmen e prevenindo o estreitamento aquando do seu encerramento (Prolene 4 ou 5/0). Já no caso da TAMI, deveremos "Fogartizar" de igual forma, mas a arteriotomia deverá ser longitudinal, preparando-a para a pontagem, necessária nestes casos, se se pretende ter resultados duradouros. A pontagem, ou bypass, como se gosta actualmente de dizer, assume-se como o tratamento definitivo da doença arterial obstrutiva e pode ser efectuada com prótese ou veia, directamente à aorta ou, mais facilmente, à artéria ilíaca esquerda. Apesar da prótese produzir melhores resultados mas devemos lembrar que se trata, muitas vezes, de território infectado que poderá contra-indicar a utilização de material estranho. Seguem-se a estas intervenções, as ressecções intestinais necessárias. É habitual anticoagular os doentes e mesmo administrar heparina sódica intra-arterial aquando do restabelecimento do fluxo, em sentido anterógrado.
Na sequência de uma laparotomia por isquémia mesentérica arterial coloca-se sempre a questão do second-look. Este procedimento deverá ser realizado sempre que haja dúvidas sobre a viabilidade das ansas intestinais após um tratamento cirúrgico com intenção curativa. Poderá ser realizado "on demand" ou programado e em contexto de controlo de dano ou não. Actualmente, considera-se mais conveniente a realização inicial de uma cirurgia de controlo de dano, com remoção das ansas isquémicas, encerramento dos topos e revisão posterior com confecção das anastomoses. Não existe apoio cientifico para este tipo de atitude, mas tem-se verificado que os resultados são aceitáveis, assim como para a generalidade da atitude de controlo de dano noutras circunstâncias. As anastomoses devem ser evitadas quando o doente se apresenta instável do ponto de vista hemodinâmico e metabólico, devendo optar-se, nestes casos, pelo controlo de danos. A segunda visita deverá ser realizada pelas 48 horas. Os estudos demonstram que para lá desse tempo aumenta a taxa de infecção e de incapacidade de encerrar o abdómen primariamente. Se realizada antes, ainda não houve tempo suficiente para que se desenvolvam os sinais de isquémia intestinal que irão decidir qual o limite da ressecção.
O tratamento da trombose mesentérica venosa passa pela anticoagulação sistémica com heparina de baixo peso molecular, substituída por um dicumarínico logo que possível. Alguns centros Americanos têm utilizado NOACs no tratamento desta situação. Se bem que a literatura e as guidelines sobre estes fármacos são omissas relativamente a esta patologia em particular, a realidade é que considerando-a como doença tromboembólica ela cai nas indicações actualmente aceites para a administração destes fármacos. Atender ao facto que, no caso dos dicumarínicos, estes interferem com os resultados analíticos na pesquisa de trombofilia,(por exemplo, proteínas C e S) pelo que só devem ser iniciados após colheita de amostra para o laboratório. De igual modo à isquémia arterial, a presença de sinais de irritação peritoneal ou de perfuração de víscera oca, deverá levar a laparotomia imediata. A maioria das vezes, o que se encontra é um segmento de delgado de aspecto edemaciado e vinoso, cuja viabilidade é, quase sempre, duvidosa e difícil de esclarecer, levando quase sempre à sua ressecção.
A NOMI é bem mais complexa. Quer na sua etiopatogenia quer no seu tratamento. Habitualmente associada a situações criticas com instabilidade hemodinâmica e utilização de aminas, ou a pós-operatório de cirurgias major, habitualmente cardíaca ou vascular, testemunha uma isquémia distal do território esplâncnico provocada défice de volume ou vasoconstrição extrema deste território vascular. A sua resolução passa pelo tratamento das condições de base que levaram a esse estado de défice perfusional e, a maioria das vezes, a ressecção dos segmentos intestinais, habitualmente delgado, atingidos. A mortalidade é muito alta, devido ao mau estado dos doentes e também à necessidade de ressecções muito amplas.
A forma como olhamos para a isquémia mesentérica poderá modificar-se nos próximos tempos. Em grande medida, o prognóstico está ligado à rapidez com que se chega ao diagnóstico. Essa precocidade, agora dependente do índice de suspeição do Médico que observa o doente, poderá ser dependente, no futuro próximo,de uma análise laboratorial especifica e barata. Vários grupos têm investigado o poder discriminativo de marcadores de necrose intestinal, componentes da mucosa digestiva. Infelizmente, a aplicação prática de uma descoberta como esta, parece ainda distante, dado que os vários marcadores testados não se têm mostrado particularmente específicos da AMI,apesar da sua elevada sensibilidade. Vamos ter de esperar. Até lá, temos de pensar neste diagnóstico como uma possibilidade em todos os doentes incluídos nos de risco.
Não se esqueçam de dar uma olhadela ao artigo das Guidelines que está disponível on line.
Vou discutir neste texto apenas alguns aspectos mais práticos.
“Occlusion of the mesenteric vessels is regarded as one of those conditions in which the diagnosis is impossible, the prognosis hopeless, and the treatment almost useless”.
Esta frase, proferida por Cokkinis há mais de 70 anos atrás, revela um pessimismo que ainda hoje prevalece, quando falamos de isquémia mesentérica aguda (AMI). Para esta opinião contribui o mau prognóstico destes doentes, que se tem mantido ao longo de décadas, apesar da evolução técnica e cientifica da Medicina, em geral e da Cirurgia em particular.
A AMI constitui menos de 1% do total dos quadros de abdómen agudo que se apresentam nos Serviços de Urgência, mas cerca de 10% se os doentes tiverem idade superior a 70 anos. A mortalidade é elevada, entre 60 a 80%, sobretudo devido ao atraso diagnóstico.
A AMI pode ser dividida em 4 classes distintas:
- EAMI - embólica, a mais frequente, com origem habitual num êmbolo formado no coração.
- TAMI - trombótica, resultante da trombose de uma placa aterosclerótica na artéria mesentérica, habitualmente na sua origem.
Estas duas classes podem ser classificadas como AMI arterial oclusiva.
- VAMI - a trombose venosa, habitual numa população mais jovem e associada, frequentemente, a discrasias da coagulação.
- NOMI - a AMI não oclusiva, típica dos doentes críticos, habitualmente internados em Unidades de Cuidados Intensivos.
A doença arterial oclusiva é, de longe a mais comum. Os doentes são habitualmente idosos e portadores de patologia cardiovascular prévia, por vezes bem conhecida. A presença de arritmia cardíaca, principalmente fibrilhação auricular, sugere uma origem embólica. O inicio súbito da dor seguido de um intervalo livre de dor de duração variável (6 a 12 horas) é muito característico da oclusão embólica. A doença oclusiva trombótica tem uma apresentação mais insidiosa e por vezes, precedida de sintomas típicos de angor abdominal.
A doença venosa surge num contexto distinto. Os doentes são mais jovens, por vezes na década de 40. A associação com situações pré-trombóticas é muito frequente e entre estas o factor V de Leyden é o mais vezes encontrado. No entanto, não é de descartar a possibilidade de síndrome paraneoplásica, sobretudo de neoplasias primitivas do fígado e do pâncreas. As queixas são inespecíficas e com frequência de longa duração (vários dias ou semanas) e a sua evolução depende da extensão de delgado envolvido.
A doença não oclusiva é característica de doentes críticos. Doentes com sépsis, disfunção orgânica múltipla ou sob aminas são os mais típicos. Hemodiálise e pós-operatório de cirurgia cardíaca são outras condições que podem surgir associadas. Com o doente ventilado e entubado, as queixas clínicas são de pouco valor para levantar suspeita. Por vezes são o aparecimento súbito de distensão abdominal ou o agravamento dos parâmetros inflamatórios os primeiros indicadores da possibilidade de NOMI.
O primeiro passo para chegar ao diagnóstico é, efectivamente, a suspeita. Pensar na possibilidade de AMI é imprescindível para iniciar todo a investigação que leva a um diagnóstico precoce e a uma possibilidade de tratamento. Neste contexto, a suspeita pode ser, também, o melhor factor de bom prognóstico a favor do doente. Na presença de um doente com queixas abdominais inespecíficas, com idade e patologia associada favorável, a AMI deve fazer parte do diagnóstico diferencial inicial. O atraso diagnóstico é factor de prognóstico que mais influencia a sobrevida.
A suspeita deve levar à realização imediata de uma angioTC abdominal.
São várias as questões que se colocam relativamente à realização deste exame, porém, é apenas com ele que se podem tomar decisões relativas à subsequente atitude terapêutica. A presença de um doente com alguma instabilidade, por vezes com lesão renal aguda ou sem jejum, pode atrasar a realização da TC. No entanto, esta é uma das circunstâncias em que deverá ser realizada com a maior brevidade, sobretudo no doente que se apresenta com um quadro clínico sugestivo (dor abdominal, idade superior a 70 anos, patologia cardíaca...). Não existe nenhum outro meio diagnóstico que nos possa fornecer os dados que uma TC bem efectuada fornece. Já foram pesquisados imensos marcadores biológicos (e nós continuamos a procurar respostas na LDH, d-dimeros e lactatos, certo?) mas nenhum deles é sensível o suficiente para produzir alterações que nos conduzam ao diagnóstico em tempo útil.
Depois de conseguido um diagnóstico adequado, o doente necessita de uma ressuscitação adequada que passa pela administração de fluidos (cristalóides, quase sempre), correcção da acidose, administração de antibiótico de largo espectro e anticoagulação sistémica. A maioria destes doentes terão ser submetidos a algum tipo de intervenção para desobstrução vascular. Excluem-se os casos de trombose venosa, em que a anticoagulação pode ser suficiente e os doentes com NOMI...
Actualmente, no tratamento da doença oclusiva, podemos considerar que o Gold Standard é a angiografia e os procedimentos por via percutânea. É possível, por via endovascular, reparar estenoses da artéria mesentérica superior e mesmo remover trombos e êmbolos no seu interior. Há que salvaguardar os casos em que há sinais de irritação peritoneal ou outra evidência da existência de sofrimento irreversível das ansas intestinais, indicando, formalmente, a sua ressecção. Nestes casos, além do procedimento de revascularização, é necessária a laparotomia para remoção do tecido necrosado.
Porém, a logística necessária para estes procedimentos não está disponível em todos os Hospitais e, nestes casos, tempo é dinheiro. Assim, poderá ser necessária a abordagem primária cirúrgica para restabelecimento da continuidade vascular. Em casos de ausência de sinais que indiquem uma exploração urgente por peritonite, é aceitável a transferência do doente para um Hospital com meios imagiológicos de intervenção, caso a transferência se possa fazer de forma expedita. Nos restante casos, o Cirurgião Geral ou o Cirurgião Vascular, terão de abordar o doente com uma estratégia de revascularização em mente, além da possibilidade de ressecção intestinal. No caso da EAMI, a embolectomia da artéria mesentérica superior é, em regra, suficiente. Após um controlo proximal e distal da artéria, com dissecção cuidada, a "Fogartização" proximal e distal com verificação de retoma de fluxo é a manobra adequada. Classicamente, nestas circunstâncias, a arteriotomia deve ser transversal, permitindo o acesso ao lúmen e prevenindo o estreitamento aquando do seu encerramento (Prolene 4 ou 5/0). Já no caso da TAMI, deveremos "Fogartizar" de igual forma, mas a arteriotomia deverá ser longitudinal, preparando-a para a pontagem, necessária nestes casos, se se pretende ter resultados duradouros. A pontagem, ou bypass, como se gosta actualmente de dizer, assume-se como o tratamento definitivo da doença arterial obstrutiva e pode ser efectuada com prótese ou veia, directamente à aorta ou, mais facilmente, à artéria ilíaca esquerda. Apesar da prótese produzir melhores resultados mas devemos lembrar que se trata, muitas vezes, de território infectado que poderá contra-indicar a utilização de material estranho. Seguem-se a estas intervenções, as ressecções intestinais necessárias. É habitual anticoagular os doentes e mesmo administrar heparina sódica intra-arterial aquando do restabelecimento do fluxo, em sentido anterógrado.
Na sequência de uma laparotomia por isquémia mesentérica arterial coloca-se sempre a questão do second-look. Este procedimento deverá ser realizado sempre que haja dúvidas sobre a viabilidade das ansas intestinais após um tratamento cirúrgico com intenção curativa. Poderá ser realizado "on demand" ou programado e em contexto de controlo de dano ou não. Actualmente, considera-se mais conveniente a realização inicial de uma cirurgia de controlo de dano, com remoção das ansas isquémicas, encerramento dos topos e revisão posterior com confecção das anastomoses. Não existe apoio cientifico para este tipo de atitude, mas tem-se verificado que os resultados são aceitáveis, assim como para a generalidade da atitude de controlo de dano noutras circunstâncias. As anastomoses devem ser evitadas quando o doente se apresenta instável do ponto de vista hemodinâmico e metabólico, devendo optar-se, nestes casos, pelo controlo de danos. A segunda visita deverá ser realizada pelas 48 horas. Os estudos demonstram que para lá desse tempo aumenta a taxa de infecção e de incapacidade de encerrar o abdómen primariamente. Se realizada antes, ainda não houve tempo suficiente para que se desenvolvam os sinais de isquémia intestinal que irão decidir qual o limite da ressecção.
O tratamento da trombose mesentérica venosa passa pela anticoagulação sistémica com heparina de baixo peso molecular, substituída por um dicumarínico logo que possível. Alguns centros Americanos têm utilizado NOACs no tratamento desta situação. Se bem que a literatura e as guidelines sobre estes fármacos são omissas relativamente a esta patologia em particular, a realidade é que considerando-a como doença tromboembólica ela cai nas indicações actualmente aceites para a administração destes fármacos. Atender ao facto que, no caso dos dicumarínicos, estes interferem com os resultados analíticos na pesquisa de trombofilia,(por exemplo, proteínas C e S) pelo que só devem ser iniciados após colheita de amostra para o laboratório. De igual modo à isquémia arterial, a presença de sinais de irritação peritoneal ou de perfuração de víscera oca, deverá levar a laparotomia imediata. A maioria das vezes, o que se encontra é um segmento de delgado de aspecto edemaciado e vinoso, cuja viabilidade é, quase sempre, duvidosa e difícil de esclarecer, levando quase sempre à sua ressecção.
A NOMI é bem mais complexa. Quer na sua etiopatogenia quer no seu tratamento. Habitualmente associada a situações criticas com instabilidade hemodinâmica e utilização de aminas, ou a pós-operatório de cirurgias major, habitualmente cardíaca ou vascular, testemunha uma isquémia distal do território esplâncnico provocada défice de volume ou vasoconstrição extrema deste território vascular. A sua resolução passa pelo tratamento das condições de base que levaram a esse estado de défice perfusional e, a maioria das vezes, a ressecção dos segmentos intestinais, habitualmente delgado, atingidos. A mortalidade é muito alta, devido ao mau estado dos doentes e também à necessidade de ressecções muito amplas.
A forma como olhamos para a isquémia mesentérica poderá modificar-se nos próximos tempos. Em grande medida, o prognóstico está ligado à rapidez com que se chega ao diagnóstico. Essa precocidade, agora dependente do índice de suspeição do Médico que observa o doente, poderá ser dependente, no futuro próximo,de uma análise laboratorial especifica e barata. Vários grupos têm investigado o poder discriminativo de marcadores de necrose intestinal, componentes da mucosa digestiva. Infelizmente, a aplicação prática de uma descoberta como esta, parece ainda distante, dado que os vários marcadores testados não se têm mostrado particularmente específicos da AMI,apesar da sua elevada sensibilidade. Vamos ter de esperar. Até lá, temos de pensar neste diagnóstico como uma possibilidade em todos os doentes incluídos nos de risco.
Não se esqueçam de dar uma olhadela ao artigo das Guidelines que está disponível on line.
quarta-feira, 3 de agosto de 2016
Capítulo 12: A perspectiva moderna do trauma esplénico
No trauma fechado, ou contuso, a lesão esplénica é a mais frequente dos órgãos sólidos abdominais. Não se prenderá, a razão, com a exposição do órgão mas, talvez, com a sua fragilidade. A mortalidade associada ao trauma do baço é baixa (1 a 3%) e, a maioria das vezes relacionada com lesões concomitantes de outras localizações (sobretudo o TCE).
Nos últimos anos muito pouco se tem avançado no diagnóstico e tratamento da lesão esplénica. Na verdade, há pouco a dizer de novo sobre este assunto. Após a introdução do tratamento conservador, raros são os baços operados, para infelicidade dos internos de especialidade. Contudo, mantém-se 2 indicações cirúrgicas major: a presença de instabilidade hemodinâmica e a coexistência de sinais de peritonite.
A primeira série publicada versando sobre o tratamento conservador foi do Toronto's Hospital for sick children, em 1968. Rapidamente o paradigma mudou para as crianças, justificando-se com as diferenças anatómicas entre o baço destes doentes e dos doentes adultos e, sobretudo, por nas crianças o baço ser mais consistente e com uma cápsula mais dura, resistindo melhor ao trauma ou às suas complicações. Apesar disso, o tratamento conservador (NOM - non-operative management) foi tentado no adulto e com sucesso reprodutível. Uma revisão multi-institucional da EAST (Eastern Association for the surgery of trauma) identificou em 2011 uma taxa de NOM de 77% nos EUA. O paradigma foi mudando ao longo dos anos 90, com inicio no final da década de 80 do século passado.
Uma revisão de 5 anos efectuada no Serviço de Cirurgia 1 do CHTV, entre 2004 e 2009, identificou 50% de doentes tratados conservadoramente com uma taxa de sucesso de 76%.
Porquê NOM? Porque operar os doentes é perigoso. Evitar as complicações operatórias pode justificar a utilização de uma outra metodologia, desde que segura. Além da mortalidade operatória inerente a qualquer intervenção e a possibilidade de hemorragia pós-operatória, os doentes submetidos a esplenectomia podem sofrer episódios de tromboembolismo venoso, trombocitose e OPSI (overwhelming post operatory sepsis), esta última com uma mortalidade elevadíssima.
O NOM falha em 4 a 38% dos casos e em 90% falha nos primeiros 4 dias.
A opção por NOM tem de ser programada. Não pode ser tomada de ânimo leve. É obrigatório o cumprimento das seguintes premissas:
- Doente com estabilidade hemodinâmica
- Possível a classificação por TC
- Ausência de indicação cirúrgica por outro motivo
- Necessidade de produtos transfusionais inferior 2 UCE
- Hospital com capacidade cirúrgica e de monitorização
A questão da estabilidade hemodinâmica é pertinente. Muito frequentemente usamos essa expressão na prática clinica, mas nem sempre da forma adequada. O Professor Michael Sugrue, que muitos de vós conhecerão de nome ou dos congressos, costuma dizer que "in Ireland, stable is the place where we put the horses..." ilustrando bem como a expressão se tornou habitual no léxico médico e de forma pouco rigorosa.
A objectivação da estabilidade hemodinâmica pode ser conseguida através da utilização de scores. A WTA (Western Trauma Association) utiliza um score que me parece simples e facilmente reprodutível:
Grade 0: No significant hypotension (systolic blood pressure < 90 mm Hg) or serious tachycardia (heart rate > 130 beats/minute)
Grade 1: Hypotension or tachycardia by report but not reported in the emergency department
Grade 2: Hypotension or tachycardia responsive to initial volume loading with no ongoing fluid or pRBC requirement
Grade 3: Hypotension or tachycardia responsive to initial volume loads with modest ongoing fluid (<250 mL/hr) or pRBC transfusion
Grade 4: Hypotension or tachycardia only responsive to more than 2 liters of volume loading and the need for vigorous ongoing fluid infusion (>250 mL/hr) and pRBC transfusion
Grade 5: Hypotension unresponsive to fluid and pRBC transfusion
Moore FA, Davis JW, Moore Jr. EE, Cocanour CS et al
Western Trauma Association (WTA) Critical Decisions in Trauma: Management of Adult Blunt Splenic Trauma, JTrauma 65:1007 2008
A instabilidade define-se, neste score, como o doente que apresenta os graus 4 ou 5.
A severidade da lesão é importante e é fácil aceitar que a falência do NOM está relacionada com o grau de lesão. Tem sido utilizada um classificação guiada por TC. Esta é baseada numa classificação anatómica antiga (Moore et al.) e que não tem correspondência directa com as imagens da TC. Contudo, será bastante aproximada e tem sido utilizada como sendo equivalente e até foi incorporada na classificação ISS.
Moore EE, Cogbill TH, Malangoni M, Jurkovich GJ, Champion HR
Scaling system for organ specific injuries
http://www.aast.org/Library/TraumaTools/InjuryScoringScales.aspx#spleen
A correspondência da taxa de falência do NOM com o grau de lesão é directa: 5% para o grau I; 10% para grau II; 20% para grau III; 33% para grau IV e 75% para grau V.
Para alguns autores, o volume de hemoperitoneu, medido em ecografia ou TC, é um factor a ter em consideração na decisão de iniciar NOM. Assim como a presença de algumas alterações de natureza vascular, na TC. A presença de extravasamento de contraste, blush arterial ou fistula arteriovenosa pode pesar contra o NOM. Isto significa que é obrigatória a caracterização das lesões por TC à entrada.
Alguns outros factores que poderão ser considerados contra-indicação para NOM são a idade avançada (qual? não há consenso), a presença concomitante de lesão traumática intra-craniana, um ISS (Injury Severity Score) superior a 25 e necessidades transfusionais mantidas (após 5 UCE ou 2 UCE?).
Até há pouco tempo, nos anos 1990, esteve muito em voga a chamada cirurgia conservadora de baço. A esplenorrafia, a esplenectomia parcial e a utilização de redes ainda surgem nos manuais cirúrgicos e mesmo nos de cirurgia de trauma. Quanto a mim, esta questão está ultrapassada e essas técnicas devem ser remetidas em exclusivo para a cirurgia de rotina. É que as cirurgias conservadoras de baço eram efectuadas em doentes que hoje não são operados, são tratados conservadoramente.
Quanto à laparoscopia?
Segundo a SAGES, são consideradas indicações para a laparoscopia no trauma, no doente hemodinamicamente estável:
- Lesão abdominal suspeita (fechada ou penetrante)
- Trauma Abdominal penetrante com arma branca com penetração da cavidade duvidosa ou estabelecida
- Trauma Abdominal penetrante com arma de fogo com trajecto intra-peritoneal duvidoso
- Lesão diafragmática por trauma penetrante
E são consideradas contra-indicações:
- Instabilidade hemodinâmica
- Indicação para laparotomia (peritonite, choque, evisceração)
- Lesão abdominal óbvia ou conhecida
- Limitada aptidão laparoscópica
Portanto, doentes estáveis com trauma abdominal fechado podem ser submetidos a laparoscopia diagnóstica para excluir lesões relevantes. No entanto, alguns autores pretendem ir um pouco mais longe, apesar da escassez de dados clínicos que o suportem. Poderá ser um aspecto a desenvolver no futuro.
S. Sauerland, F. Agresta, R. Bergamaschi, G. Borzellino, et al
Laparoscopy for abdominal emergencies
Evidence-based guidelines of the European Association for Endoscopic Surgery
SurgEndosc 20: 14, 2006
Assim, actualmente o tratamento standard é o NOM. Há um papel óbvio para a angiografia com melhoria aparente dos resultados. Porém, restam dúvidas sobre aspectos básicos da nossa conduta, como sejam a intensidade e duração da monitorização e a intensidade e duração da restrição da actividade física. Tendo em conta a actuação presente e as tendências actuais, deverá ser difícil realizar estudos que nos mostrem o que fazer e modificar as atitudes que hoje tomamos.
Nos últimos anos muito pouco se tem avançado no diagnóstico e tratamento da lesão esplénica. Na verdade, há pouco a dizer de novo sobre este assunto. Após a introdução do tratamento conservador, raros são os baços operados, para infelicidade dos internos de especialidade. Contudo, mantém-se 2 indicações cirúrgicas major: a presença de instabilidade hemodinâmica e a coexistência de sinais de peritonite.
A primeira série publicada versando sobre o tratamento conservador foi do Toronto's Hospital for sick children, em 1968. Rapidamente o paradigma mudou para as crianças, justificando-se com as diferenças anatómicas entre o baço destes doentes e dos doentes adultos e, sobretudo, por nas crianças o baço ser mais consistente e com uma cápsula mais dura, resistindo melhor ao trauma ou às suas complicações. Apesar disso, o tratamento conservador (NOM - non-operative management) foi tentado no adulto e com sucesso reprodutível. Uma revisão multi-institucional da EAST (Eastern Association for the surgery of trauma) identificou em 2011 uma taxa de NOM de 77% nos EUA. O paradigma foi mudando ao longo dos anos 90, com inicio no final da década de 80 do século passado.
Uma revisão de 5 anos efectuada no Serviço de Cirurgia 1 do CHTV, entre 2004 e 2009, identificou 50% de doentes tratados conservadoramente com uma taxa de sucesso de 76%.
Porquê NOM? Porque operar os doentes é perigoso. Evitar as complicações operatórias pode justificar a utilização de uma outra metodologia, desde que segura. Além da mortalidade operatória inerente a qualquer intervenção e a possibilidade de hemorragia pós-operatória, os doentes submetidos a esplenectomia podem sofrer episódios de tromboembolismo venoso, trombocitose e OPSI (overwhelming post operatory sepsis), esta última com uma mortalidade elevadíssima.
O NOM falha em 4 a 38% dos casos e em 90% falha nos primeiros 4 dias.
A opção por NOM tem de ser programada. Não pode ser tomada de ânimo leve. É obrigatório o cumprimento das seguintes premissas:
- Doente com estabilidade hemodinâmica
- Possível a classificação por TC
- Ausência de indicação cirúrgica por outro motivo
- Necessidade de produtos transfusionais inferior 2 UCE
- Hospital com capacidade cirúrgica e de monitorização
A questão da estabilidade hemodinâmica é pertinente. Muito frequentemente usamos essa expressão na prática clinica, mas nem sempre da forma adequada. O Professor Michael Sugrue, que muitos de vós conhecerão de nome ou dos congressos, costuma dizer que "in Ireland, stable is the place where we put the horses..." ilustrando bem como a expressão se tornou habitual no léxico médico e de forma pouco rigorosa.
A objectivação da estabilidade hemodinâmica pode ser conseguida através da utilização de scores. A WTA (Western Trauma Association) utiliza um score que me parece simples e facilmente reprodutível:
Grade 0: No significant hypotension (systolic blood pressure < 90 mm Hg) or serious tachycardia (heart rate > 130 beats/minute)
Grade 1: Hypotension or tachycardia by report but not reported in the emergency department
Grade 2: Hypotension or tachycardia responsive to initial volume loading with no ongoing fluid or pRBC requirement
Grade 3: Hypotension or tachycardia responsive to initial volume loads with modest ongoing fluid (<250 mL/hr) or pRBC transfusion
Grade 4: Hypotension or tachycardia only responsive to more than 2 liters of volume loading and the need for vigorous ongoing fluid infusion (>250 mL/hr) and pRBC transfusion
Grade 5: Hypotension unresponsive to fluid and pRBC transfusion
Moore FA, Davis JW, Moore Jr. EE, Cocanour CS et al
Western Trauma Association (WTA) Critical Decisions in Trauma: Management of Adult Blunt Splenic Trauma, JTrauma 65:1007 2008
A instabilidade define-se, neste score, como o doente que apresenta os graus 4 ou 5.
A severidade da lesão é importante e é fácil aceitar que a falência do NOM está relacionada com o grau de lesão. Tem sido utilizada um classificação guiada por TC. Esta é baseada numa classificação anatómica antiga (Moore et al.) e que não tem correspondência directa com as imagens da TC. Contudo, será bastante aproximada e tem sido utilizada como sendo equivalente e até foi incorporada na classificação ISS.
 | |
Scaling system for organ specific injuries
http://www.aast.org/Library/TraumaTools/InjuryScoringScales.aspx#spleen
A correspondência da taxa de falência do NOM com o grau de lesão é directa: 5% para o grau I; 10% para grau II; 20% para grau III; 33% para grau IV e 75% para grau V.
Para alguns autores, o volume de hemoperitoneu, medido em ecografia ou TC, é um factor a ter em consideração na decisão de iniciar NOM. Assim como a presença de algumas alterações de natureza vascular, na TC. A presença de extravasamento de contraste, blush arterial ou fistula arteriovenosa pode pesar contra o NOM. Isto significa que é obrigatória a caracterização das lesões por TC à entrada.
Alguns outros factores que poderão ser considerados contra-indicação para NOM são a idade avançada (qual? não há consenso), a presença concomitante de lesão traumática intra-craniana, um ISS (Injury Severity Score) superior a 25 e necessidades transfusionais mantidas (após 5 UCE ou 2 UCE?).
Um aspecto importante é o da monitorização. Um Hospital onde se pretende fazer NOM tem de ter essa capacidade. A literatura é unânime em considerar necessária a monitorização continua dos sinais vitais durante 3 dias, com avaliação da Hemoglobina de 6/6 horas. A repetição da TC às 48 horas pode justificar-se pelos 6% de lesões que surgem tardiamente.
A profilaxia do tromboembolismo venoso é obrigatório, sendo instituído NOM ou não. Ressalvando as respectivas contra-indicações, claro.
Outra questão pertinente é a da retoma da actividade física. Ninguém sabe como proceder. Existem recomendações, mas não pode dizer-se que são baseadas em dados concretos, pois não existem estudos. Porém, arriscaria sugerir o seguinte esquema:
Grau I-II:
Evitar esforços físicos e desporto 6 semanas
Evitar trabalho pesado 6 a 8 semanas
Iniciar actividades domésticas após 2 semanas
Grau ≥III :
Actividade mínima 1 semana
Actividade ligeira 4 a 8 semanas;
Evitar esforços físicos e desporto 6 semanas
Evitar trabalho pesado 10 a 12 semanas
Grau IV, V:
Evitar esforços físicos e desporto 3 meses
A angioembolização assume no NOM um papel importante, podendo ser um adjuvante na redução da falência do tratamento médico, sobretudo em circunstâncias especificas. É o caso das lesões grau IV e V, dos doentes com hemoperitoneu moderado (e como definir isto?) e na presença das anomalias vasculares anteriormente descritas, identificadas na TC. Alguns algoritmos incluem a angioembolização como passo antes da cirurgia e, por vezes, em sua substituição. No entanto, a angioembolização também pode falhar (em 5 a 9% dos casos) e não é isenta de complicações (19 a 28%) que podem reduzir-se se se optar por embolizações mais distais. O abcesso esplénico, o enfarte esplénico extenso, o derrame pleural, a lesão vascular no local do acesso e a hemorragia recorrente são algumas das complicações possíveis, as mais frequentes. Não obstante, a angiografia pode elevar o sucesso do NOM até aos 97%...
Não se conhece o efeito, ou melhor, o prejuízo imunológico produzido pela angioembolização, pelo que se recomenda vacinar de igual forma aos doentes operados.
É interessante notar que alguns autores acreditam que no traumatismo esplénico isolado, a angiografia pode substituir a cirurgia, mesmo em doentes hemodinamicamente instáveis. Para desmistificar a questão relacionada com o tempo (mais rapidamente se opera...), Olthof et al. comparou o intervalo de tempo entre a entrada do doente e a chegada à suite de angio versus Bloco operatório e não verificou diferenças de relevo. Aliás, as diferenças existentes favoreciam a angiografia. Temos de convir que se trata de realidades muito dispares das nossas.
Até há pouco tempo, nos anos 1990, esteve muito em voga a chamada cirurgia conservadora de baço. A esplenorrafia, a esplenectomia parcial e a utilização de redes ainda surgem nos manuais cirúrgicos e mesmo nos de cirurgia de trauma. Quanto a mim, esta questão está ultrapassada e essas técnicas devem ser remetidas em exclusivo para a cirurgia de rotina. É que as cirurgias conservadoras de baço eram efectuadas em doentes que hoje não são operados, são tratados conservadoramente.
Quanto à laparoscopia?
Segundo a SAGES, são consideradas indicações para a laparoscopia no trauma, no doente hemodinamicamente estável:
- Lesão abdominal suspeita (fechada ou penetrante)
- Trauma Abdominal penetrante com arma branca com penetração da cavidade duvidosa ou estabelecida
- Trauma Abdominal penetrante com arma de fogo com trajecto intra-peritoneal duvidoso
- Lesão diafragmática por trauma penetrante
E são consideradas contra-indicações:
- Instabilidade hemodinâmica
- Indicação para laparotomia (peritonite, choque, evisceração)
- Lesão abdominal óbvia ou conhecida
- Limitada aptidão laparoscópica
Portanto, doentes estáveis com trauma abdominal fechado podem ser submetidos a laparoscopia diagnóstica para excluir lesões relevantes. No entanto, alguns autores pretendem ir um pouco mais longe, apesar da escassez de dados clínicos que o suportem. Poderá ser um aspecto a desenvolver no futuro.
 | ||||
S. Sauerland, F. Agresta, R. Bergamaschi, G. Borzellino, et al
Laparoscopy for abdominal emergencies
Evidence-based guidelines of the European Association for Endoscopic Surgery
SurgEndosc 20: 14, 2006
terça-feira, 2 de agosto de 2016
Capítulo 11: Hematoma espontâneo
Em 2013 fui convidado para falar sobre este tema em Lyon, no Congresso da ESTES. Achei um disparate haver uma keynote lecture sobre um tema tão obscuro. E raro, achava eu. Mas aceitei o desafio. E o que descobri foi, deveras, surpreendente. Não só não é assim tão raro, como o seu manuseamento não é fácil, nem consensual. Havendo tantas possibilidades relacionadas com hematomas espontâneos, optei por me cingir a uma área mais ligada à Cirurgia Geral, o hematoma espontâneo abdominal extra-peritoneal.
A primeira coisa que descobri é que raras vezes ele é verdadeiramente espontâneo. Se procurarmos bem, quase sempre conseguimos encontrar uma causa predisponente. Nestes casos, excluem-se sempre os de origem traumática. Os factores de risco mais frequentemente associados são: idade avançada, hipertensão, doença cardíaca, aterosclerose, doença renal, gravidez e discrasias sanguíneas. Infelizmente, nos dias de hoje, começam a surgir outros factores de risco, importantes pela gravidade dos hematomas a eles associados. Refiro-me à utilização de anticoagulantes orais, antiagregantes plaquetares e heparina, não fraccionada e de baixo peso molecular.
Além destes factores, ditos de risco, existem factores precipitantes. Estes podem ser definidos como um esforço físico de grandeza variada, mas passível de produzir disrupção vascular e hemorragia. São exemplos a tosse, o espirro ou uma outra contracção muscular vigorosa. E sim, o sexo também.
Os verdadeiramente espontâneos seriam aqueles em que nenhum destes factores, de risco ou precipitantes, fosse identificado. Isso acontece em cerca de 8% dos casos, o que, como compreendem, é pouco habitual. E o facto de não se ter encontrado, não quer dizer que não exista, certo?
Não se sabe bem porquê nem como, mas a hemorragia é multifocal. Vários factores foram apontados para este achado, mas a contribuição individual de cada um é desconhecida. Diversos autores referem a existência de arteriosclerose difusa de pequenos vasos, microangiopatia (esta associada ao uso de heparina), vasculopatia oculta e desconhecida e trauma minor não reconhecido.
O hematoma extra-peritoneal pode surgir na bainha dos músculos rectos do abdómen (o mais frequente) ou no retroperitoneu, quer em estruturas musculares (músculo psoas) ou não (glândula supra-renal). O quadro clínico caracteriza-se por dor e distensão, podendo mesmo identificar-se uma massa abdominal. A presença de equimose superficial é, sempre, um sinal tardio.
A melhor ajuda para chegar ao diagnóstico desta situação é ter tido experiência prévia de um caso. Raramente sem pensa nesta possibilidade e, habitualmente, gasta-se uma bateria de exames para excluir múltiplas outras situações mórbidas, sendo o diagnóstico final um achado imagiológico. Por isso, o diagnóstico diferencial é muito extenso... Inclui basicamente tudo o que pode cursar com dor abdominal.
A ecografia e a TC são os exames que mais ajudam. O primeiro no despiste e o segundo na caracterização. Infelizmente, a TC nem sempre é realizada com esta suspeita e os tempos relativamente à administração de contraste podem não ser as melhores para uma boa caracterização da lesão e, sobretudo, da hemorragia presente. Este é um dos aspectos mais importantes e que pode ser determinante na escolha do tratamento mais adequado. A presença de hemorragia activa ou de sinais de potencial de hemorragia continuada são fundamentais.
O tratamento inicial é conservador. Isto significa internamento, repouso no leito, gelo local, analgesia, reversão da anticoagulação caso exista, transfusão se necessário e monitorização. Em cerca de 80% dos casos não é necessário mais do que isso. Porém, esta atitude associa-se com internamento prolongado, em média, 20 dias.
Existem 5 circunstâncias que obrigam a uma atitude diferente:
- A presença de instabilidade hemodinâmica
- A presença de dor incapacitante não controlável
- A necessidade continuada de produtos de transfusão
- A presença de uma síndrome de compartimento e
- O desenvolvimento de infecção
Na presença de sinais de instabilidade hemodinâmica, motivada pela hemorragia continuada de um volume sanguíneo significativo, podemos optar por cirurgia ou angiografia. A velha discussão sobre quem tem angiografia e/ou não, é importante, mas fora do âmbito deste texto. Quem não tem angiografia, tem de operar. A cirurgia consiste na evacuação do hematoma e na sutura e laqueação dos vasos sangrantes (vasos... plural). Os poucos estudos que existem sobre angioembolização apontam para uma taxa de sucesso próxima dos 100%, com uma mortalidade de 0%. Porém, são poucos e não há estudos comparativos com a cirurgia. De acrescentar que todos eles referem a necessidade de TC prévia para guiar a superselectividade do procedimento, caso contrário a morbilidade pode ser demasiado elevada (necrose muscular extensa). Não são, no entanto, de desprezar as vantagens óbvias sobre a cirurgia: a invasibilidade mínima e a taxa elevada de sucesso (98%).
O tratamento da dor não controlável é cirúrgico - evacuar e laquear. A dor mantida é usualmente causada pelo aumento progressivo, gradual e lento, da pressão dentro do hematoma por hemorragia continuada de baixo débito. Há algumas descrições de aspiração percutânea, mas associada a um elevado risco de infecção e de evacuação incompleta, pelo que não deve ser utilizada.
Em caso de necessidade continuada de produtos de transfusão, deve realizar-se uma angioTC. Se existe blush arterial, o tratamento de escolha é a angioembolização. Caso não exista, o tratamento deverá ser a evacuação cirúrgica e a laqueação dos vasos sangrantes.
A síndrome de compartimento pode manifestar-se de 3 formas distintas, dependendo do compartimento envolvido. Em caso de síndrome de compartimento abdominal, o tratamento é a laparostomia, acabando por se evacuar e laquear, à semelhança do que já foi referido. A síndrome compartimental pode, também, manifestar-se como défice neurológico. A opção por descompressão cirúrgica precoce leva a melhores resultados funcionais e a uma recuperação mais rápida. No entanto, há autores que defendem o tratamento conservador por medo das complicações da cirurgia. Esta opção leva a uma recuperação tardia e, habitualmente, incompleta. Por fim, o défice vascular, manifestado nos membros inferiores, necessita de descompressão cirúrgica precoce e, muitas vezes, fasciotomia.
A infecção é, na maioria dos casos, iatrogénica. Muitas vezes é difícil resistir puncionar estas colecções e este é o preço a pagar. E pode ser um preço muito elevado. O desenvolvimento de um abcesso necessita de um desbridamento amplo, tratamento sistémico com antibióticos de largo espectro e "rezar" para que não se desenvolva uma fasceíte que pode culminar na morte do doente.
Em Conclusão:
Trata-se de uma entidade rara mas com uma frequência crescente, paralela ao crescimento da utilização de fármacos com efeito na coagulação e na trombose. É de muito difícil diagnóstico, sendo habitualmente identificada imagiologicamente quando se procura outra causa para os sintomas. A abordagem destes doentes deve ser multidisciplinar (está na moda) e iniciar-se pelo tratamento conservador e avançar para tratamentos mais invasivos nos casos indicados.
sábado, 16 de julho de 2016
Capítulo 10: Trauma - Parte I: Cuidados integrados em trauma
Como em muitas outras situações na vida, tendemos a copiar uns dos outros as coisas que funcionam bem. E, como em muitas outras situações na vida, nós "tugas", tendemos a fazê-lo demasiado tarde. Em relação ao trauma temos décadas em atraso.
Durante muitos anos foi tudo ao molho em fé em Deus. Ainda me lembro desses tempos. Cada vez que entrava o que podia ser um traumatizado grave no Serviço de Urgência, todo o pessoal caía sobre o doente e eu, jovem interno do primeiro ano, tinha que nadar através de um mar de gente só para conseguir fazer uma gasimetria... Depois apareceu o ATLS. E, de repente pareceu que a grande preocupação de todos era o trauma. Vários tipos de formação pós-graduada ligadas ao trauma surgiram como cogumelos em todo o lado... Não posso afirmar que tudo foi mau, porque não é verdade. A tomada de consciência para o trauma despertou um gosto especial pelo tratamento do doente crítico em todos os profissionais ligados à saúde, levando a uma evolução nos cuidados críticos e na forma como abordamos esses doentes que se sente até hoje. Nessa onda surgiram conceitos de controlo de dano, resuscitação hemostática, cirurgia fisiológica... mas, não é esse o tema que me traz aqui hoje.
Os cuidados integrados em trauma são um conceito muito antigo. A primeira pessoa a pensar nisso como sendo uma necessidade para melhoria de cuidados foi, provavelmente, Jean Dominique Larrey. Este membro da aristocracia francesa do século XIX, cirurgião do Imperador Napoleão, inventou a ambulância e os Hospitais de campanha, reduzindo em mais de um terço a mortalidade dos combatentes franceses que participaram nas invasões napoleónicas.
O conceito essencial quando se fala em cuidado integrados é o de Rede de Trauma. A Rede de Trauma pode ser definida como uma resposta planeada e coordenada ao doente vitima de trauma capaz de providenciar tratamento standard e adequado em tempo útil, independentemente do local em que a vitima seja observada. Este conceito é originário de países em que a incidência do trauma é elevada, sobretudo do trauma penetrante, mas é útil para países em que a incidência é baixa, produzindo um estado de alerta permanente e mantendo o sistema preparado para actuar. Uma Rede de Trauma adequada integra múltiplos elementos, desde o atendimento no local até à re-integração da vitima na sociedade. E é esta integração dos elementos em rede que permite, não só melhorar os cuidados, mas também evitar a duplicação de recursos e maximizar a utilização dos recursos existentes. Parecendo uma questão perfeitamente lapalissiana, a realidade é, no entanto, bem distinta. Tem havido várias tentativas de produzir, ou reproduzir uma espécie de Sistema de Trauma no nosso país. Porém, tem havido dificuldades. Desde 2010 que a Direcção Geral de Saúde tornou obrigatória a criação de uma Via Verde de Trauma nos Hospitais, através da publicação de um Norma em março/2010, para cumprimento até ao fim de 2011. Estamos em 2016 e conheço poucos hospitais onde foi implementada.
O Sistema de Trauma deve incluir normas e regras relativas à abordagem pré-hospitalar e hospitalar, mas também à prevenção e reabilitação. E é fundamental, que possua um mecanismo de auto-avaliação.
O Sistema de Trauma adequado deve ser inclusivo. Isto significa que tem de providenciar cuidados de qualidade a todos os doentes, independentemente da sua gravidade, mas também utilizar todos os recursos disponíveis de todos os hospitais da região, evitando assim o "afogamento" dos grandes centros com casos minor. O que importa é que cada doente receba o tratamento adequado à gravidade das suas lesões. O objectivo de um sistema inclusivo é, portanto, equiparar os recursos de cada hospital com as necessidades de cada doente aí transportado. Para tal é necessário uma sistema de triagem que deverá iniciar-se desde a abordagem pré-hospitalar, com apoio médico, de forma a decidir para onde o doente é referenciado. Esta metodologia permite que as vitimas mais graves sejam sempre atendidas num centro de cuidados mais diferenciados, que serão apenas 5 a 10% dos casos, mas que consomem mais recursos. E poupa-se tempo.
O sistema integrado, com todas as suas componentes, é capaz de reduzir o número de acidentes, através de manobras preventivas eficazes e reduzir a morbilidade, reduzir os tempos de internamento, reduzir os custos das incapacidades e produzir uma recuperação mais rápida, através de uma melhor qualidade de cuidados.
Todos os aspectos aludidos são importantes. A maioria das vezes que pensamos em trauma, pensamos na sua elevada mortalidade, sobretudo em doentes jovens, em idade activa. Mas não devemos esquecer que por cada doente que morre, há 3 que ficam permanentemente incapacitados e, por isso, os encargos pessoais, familiares e sociais envolvidos são avultados. O trauma é, também, uma causa major de absentismo laboral.
 A integração da sala de atendimento ao trauma dentro de cada centro é dependente dos recursos disponíveis. Actualmente fala-se muito nas salas híbridas, com capacidade de atendimento primário, cirurgia e até imagiologia. A sala de atendimento ao trauma, ou sala de emergência, ou sala de reanimação, ou sala zero (muitas designações ao longo deste país tão pequeno) serve para conduzir a recepção, a reanimação e optimização do doente, permitindo a sua transferência para o local onde serão providenciados os cuidados definitivos de forma segura. É mandatória a existência de linhas de orientação de funcionalidade com áreas ou entidades afins, no sentido de maximizar a eficácia, a qualidade e a rapidez de atendimento:
A integração da sala de atendimento ao trauma dentro de cada centro é dependente dos recursos disponíveis. Actualmente fala-se muito nas salas híbridas, com capacidade de atendimento primário, cirurgia e até imagiologia. A sala de atendimento ao trauma, ou sala de emergência, ou sala de reanimação, ou sala zero (muitas designações ao longo deste país tão pequeno) serve para conduzir a recepção, a reanimação e optimização do doente, permitindo a sua transferência para o local onde serão providenciados os cuidados definitivos de forma segura. É mandatória a existência de linhas de orientação de funcionalidade com áreas ou entidades afins, no sentido de maximizar a eficácia, a qualidade e a rapidez de atendimento:
Durante muitos anos foi tudo ao molho em fé em Deus. Ainda me lembro desses tempos. Cada vez que entrava o que podia ser um traumatizado grave no Serviço de Urgência, todo o pessoal caía sobre o doente e eu, jovem interno do primeiro ano, tinha que nadar através de um mar de gente só para conseguir fazer uma gasimetria... Depois apareceu o ATLS. E, de repente pareceu que a grande preocupação de todos era o trauma. Vários tipos de formação pós-graduada ligadas ao trauma surgiram como cogumelos em todo o lado... Não posso afirmar que tudo foi mau, porque não é verdade. A tomada de consciência para o trauma despertou um gosto especial pelo tratamento do doente crítico em todos os profissionais ligados à saúde, levando a uma evolução nos cuidados críticos e na forma como abordamos esses doentes que se sente até hoje. Nessa onda surgiram conceitos de controlo de dano, resuscitação hemostática, cirurgia fisiológica... mas, não é esse o tema que me traz aqui hoje.
Os cuidados integrados em trauma são um conceito muito antigo. A primeira pessoa a pensar nisso como sendo uma necessidade para melhoria de cuidados foi, provavelmente, Jean Dominique Larrey. Este membro da aristocracia francesa do século XIX, cirurgião do Imperador Napoleão, inventou a ambulância e os Hospitais de campanha, reduzindo em mais de um terço a mortalidade dos combatentes franceses que participaram nas invasões napoleónicas.
O conceito essencial quando se fala em cuidado integrados é o de Rede de Trauma. A Rede de Trauma pode ser definida como uma resposta planeada e coordenada ao doente vitima de trauma capaz de providenciar tratamento standard e adequado em tempo útil, independentemente do local em que a vitima seja observada. Este conceito é originário de países em que a incidência do trauma é elevada, sobretudo do trauma penetrante, mas é útil para países em que a incidência é baixa, produzindo um estado de alerta permanente e mantendo o sistema preparado para actuar. Uma Rede de Trauma adequada integra múltiplos elementos, desde o atendimento no local até à re-integração da vitima na sociedade. E é esta integração dos elementos em rede que permite, não só melhorar os cuidados, mas também evitar a duplicação de recursos e maximizar a utilização dos recursos existentes. Parecendo uma questão perfeitamente lapalissiana, a realidade é, no entanto, bem distinta. Tem havido várias tentativas de produzir, ou reproduzir uma espécie de Sistema de Trauma no nosso país. Porém, tem havido dificuldades. Desde 2010 que a Direcção Geral de Saúde tornou obrigatória a criação de uma Via Verde de Trauma nos Hospitais, através da publicação de um Norma em março/2010, para cumprimento até ao fim de 2011. Estamos em 2016 e conheço poucos hospitais onde foi implementada.
O Sistema de Trauma deve incluir normas e regras relativas à abordagem pré-hospitalar e hospitalar, mas também à prevenção e reabilitação. E é fundamental, que possua um mecanismo de auto-avaliação.
O Sistema de Trauma adequado deve ser inclusivo. Isto significa que tem de providenciar cuidados de qualidade a todos os doentes, independentemente da sua gravidade, mas também utilizar todos os recursos disponíveis de todos os hospitais da região, evitando assim o "afogamento" dos grandes centros com casos minor. O que importa é que cada doente receba o tratamento adequado à gravidade das suas lesões. O objectivo de um sistema inclusivo é, portanto, equiparar os recursos de cada hospital com as necessidades de cada doente aí transportado. Para tal é necessário uma sistema de triagem que deverá iniciar-se desde a abordagem pré-hospitalar, com apoio médico, de forma a decidir para onde o doente é referenciado. Esta metodologia permite que as vitimas mais graves sejam sempre atendidas num centro de cuidados mais diferenciados, que serão apenas 5 a 10% dos casos, mas que consomem mais recursos. E poupa-se tempo.
O sistema integrado, com todas as suas componentes, é capaz de reduzir o número de acidentes, através de manobras preventivas eficazes e reduzir a morbilidade, reduzir os tempos de internamento, reduzir os custos das incapacidades e produzir uma recuperação mais rápida, através de uma melhor qualidade de cuidados.
Todos os aspectos aludidos são importantes. A maioria das vezes que pensamos em trauma, pensamos na sua elevada mortalidade, sobretudo em doentes jovens, em idade activa. Mas não devemos esquecer que por cada doente que morre, há 3 que ficam permanentemente incapacitados e, por isso, os encargos pessoais, familiares e sociais envolvidos são avultados. O trauma é, também, uma causa major de absentismo laboral.
No nosso país, a principal causa de trauma grave é a sinistralidade rodoviária. Depois, as quedas, sobretudo numa população mais idosa. E os números, apesar de terem melhorado gradualmente ao longo dos últimos anos, continuam assustadores. Há 20 anos, o trauma era responsável por cerca de 850 mortes por ano, de um total de 350.000 "acidentes". Já em 2009 morreram 1039 pessoas (a população também cresceu...) só em acidentes de viação. Ainda há muito a fazer do ponto de vista preventivo.
Por isso, o primeiro aspecto a ter em consideração é a prevenção. A prevenção em trauma é um pouco descurada pelas autoridades e mesmo pelos profissionais de saúde. Quem tem preocupações mais atentas sobre esta questão são os engenheiros: os que fazem as estradas, os que fazem as pontes, os que constroem os carros e as motas... Há 4 tipos de prevenção: a primária, cujo objectivo é evitar que aconteça o evento (a obrigatoriedade da carta de condução é um exemplo); a secundária, cujo objectivo é minimizar os efeitos após o evento ter acontecido (cinto de segurança, airbag, rails...), a terciária, cujo objectivo é evitar as complicações do evento (hospitais, ATLS...) e, por fim, a quaternária que permite impedir que o evento se repita (tratamento de reabilitação anti-alcoólica). Estes aspectos são estudados de forma exaustiva por vários tipos de cientistas que depois criaram uma espécie de grelha de integração dos diversos aspectos a que deram o nome de Haddon Matrix, que é auto explicativa:
 | |||
|
Daqui resultam os quatro E's da estratégia preventiva: Education (mais uma vez a carta de condução), Enforcement (multas, etc.), Engineering (construtoras) e Economics (como em tudo).
O aspecto seguinte é a abordagem pré-hospitalar. E voltamos a falar novamente no Jean Dominique Larrey. De facto, o conceito que ele implementou nos campos de batalha traduz muito bem o que deve ser o serviço pré-hospitalar hoje: acesso rápido ao local, atendimento e transporte para cuidados definitivos. Quem deve estar envolvido neste serviço depende muito da disponibilidade dos recursos humanos e das características geográficas locais. É compreensível que numa cidade como Nova Yorque, a utilização de médicos na rua não é exequível, mas na nossa realidade é e funciona muito bem. O tipo de atendimento local (scoop & run vs stay & play) depende da avaliação efectuada e do tipo de situação presente. Actualmente dá-se preferência ao scoop and run, mas nem todas as situações se adequarão a esse método. O local para onde a vitima vai deve ser o centro mais próximo e mais adequado. Tive o cuidado de não escrever Hospital mas centro, o que ficará explicado em seguida. A abordagem pré-hospitalar deve ter, obrigatoriamente, controlo médico, seja directo, por protocolos ou por outro meio que se entenda eficaz. E deve ter algum tipo de controlo de qualidade e auditoria regular. Só dessa forma podemos perceber o que fazemos e se estamos a fazê-lo bem. Não vou tecer comentários sobre recursos materiais e meios de transporte em cuidados pré-hospitalares por entender não ser esse o objectivo deste texto. Mas não posso deixar de referir a questão da triagem. Num sistema de trauma inclusivo, a triagem é fundamental. É na triagem que se baseia, em grande medida, o sucesso do sistema, permitindo algum grau de sobretriagem, evitando o mal maior que é a subtriagem. É preferível que um doente ligeiro seja abordado inicialmente num centro de elevada diferenciação do que um grave num centro não diferenciado e necessitar de uma transferência secundária. A triagem mais utilizada no mundo baseia-se em critérios fisiológicos, anatómicos, lesionais e de comorbilidades, tentando calcular a gravidade da vitima de forma a poder classificá-la e com resultado desse cálculo, seleccionar o local de abordagem inicial. Trata-se de um sistema de avaliação progressivo, que, permitindo alguma subjectividade, envia o doente para o nível de cuidados superior sempre que haja dúvidas e assim, evita a subtriagem. Ou redu-la o mais possível.
 |
| http://www.scrtac.org/SCRTAC_Transport_Guidelines.html |
O Centro de Trauma é um hospital/centro de atendimento dentro do sistema, equipado para lidar com doentes vitimas de trauma múltiplo e definido de acordo com a sua localização estratégica e acessibilidade, o tipo de recursos disponíveis, incluindo a diferenciação técnica e cientifica dos seus profissionais, e pela casuística. É obrigatória a sua adesão a standards e normas de boa prática clinica e administrativa, bem como a uma constante avaliação do seu funcionamento como Centro de Trauma. Os diferentes pontos da rede, os Centros de Trauma, deverão estar, idealmente, a menos de 30 minutos de qualquer local de ocorrência na sua área. Em alternativa, o serviço pré-hospitalar deverá acorrer a esse local no mesmo tempo. Já a distância entre dois pontos da rede deverá ser no máximo de 2 horas.
Os Centros de Trauma são classificados de acordo com as suas capacidades em: Nível 1. centro que dispõe de todas as valências, deverá receber mais de 250 doentes com ISS superior a 15 por ano;
Nível 2. centro com capacidade cirúrgica (Cirurgia Geral e Ortopedia), devendo existir protocolos entre estes e os de nível 1 para as transferências necessárias e Nível 3. centros de atendimento básico.
Introduzem-se, aqui, dois conceitos novos: o de ISS e o de nível de atendimento. ISS refere-se ao Injury Severity Score que, embora com algumas falhas em termos de classificação lesional, é o score mais usado para uniformizar critérios e avaliar os Centros de Trauma quanto à sua capacidade de execução e casuística. Já os níveis de atendimento referem-se a real capacidade do centro dentro do sistema. Os recursos serão distribuídos com base nesta classificação. Assim, os centros de nível 3, os mais básicos, poderiam, na nossa realidade, ser Centros de Saúde apetrechados com sala de recepção de agudos. A equipe mínima é constituída por um médico, um enfermeiro e um auxiliar. Os centros de nível 2 poderão ser representados por Hospitais com capacidade cirúrgica, não centrais. Aqui, a equipe já deve incluir um Cirurgião, Intensivista, um Anestesista e um Ortopedista, além do mínimo já aludido. Os centros de nível 3, o mais elevado, os clássicos Hospitais Centrais ou Universitários, dispõe de 2 equipes, uma executiva, que tem de incluir obrigatoriamente os já referidos anteriormente acrescido de um Neurocirurgião, um Imagiologista e um 2º enfermeiro. A equipe consultiva é constituída por todo e qualquer profissional que possa ser necessário durante o tratamento e gestão do doente vitima de trauma (Cirurgia Plástica, Cirurgia Maxilo-facial, Cirurgia, Vascular, Gastroenterologia, Pneumologia, Medicina Física e Reabilitação, Psiquiatria, Cirurgia Cardio-torácica, etc.). A equipe deve primar pelo rigor e conhecimento cientifico, ser diligente no tratamento dos seus doentes e ser capaz de funcionar como uma equipe coesa. O Team Leader, peça fundamental neste jogo, tem de ter a noção de que o trabalho é de risco e tem de ser capaz de tomar decisões difíceis e rapidamente. Tem de ser um médico experiente, disponível e com uma bagagem cientifica apropriada. Na minha opinião, esta figura central tem de ser um Cirurgião. O conhecimento sobre a fisiologia do doente e da fisiopatologia do trauma faz do Cirurgião Geral a pessoa ideal para coordenar uma equipa tão díspar de elementos, muitos deles afastados dos meandros da urgência e por isso pouco conhecedores das alterações agudas próprias deste tipo de vitimas. Sem conhecer essas alterações e suas consequências para o prognóstico, é impossível tomar decisões de forma adequada. É fundamental que esta equipe conheça, e idealmente tenha formação, em suporte avançado de vida em trauma.
 A integração da sala de atendimento ao trauma dentro de cada centro é dependente dos recursos disponíveis. Actualmente fala-se muito nas salas híbridas, com capacidade de atendimento primário, cirurgia e até imagiologia. A sala de atendimento ao trauma, ou sala de emergência, ou sala de reanimação, ou sala zero (muitas designações ao longo deste país tão pequeno) serve para conduzir a recepção, a reanimação e optimização do doente, permitindo a sua transferência para o local onde serão providenciados os cuidados definitivos de forma segura. É mandatória a existência de linhas de orientação de funcionalidade com áreas ou entidades afins, no sentido de maximizar a eficácia, a qualidade e a rapidez de atendimento:
A integração da sala de atendimento ao trauma dentro de cada centro é dependente dos recursos disponíveis. Actualmente fala-se muito nas salas híbridas, com capacidade de atendimento primário, cirurgia e até imagiologia. A sala de atendimento ao trauma, ou sala de emergência, ou sala de reanimação, ou sala zero (muitas designações ao longo deste país tão pequeno) serve para conduzir a recepção, a reanimação e optimização do doente, permitindo a sua transferência para o local onde serão providenciados os cuidados definitivos de forma segura. É mandatória a existência de linhas de orientação de funcionalidade com áreas ou entidades afins, no sentido de maximizar a eficácia, a qualidade e a rapidez de atendimento:
- com o pré-hospitalar: INEM, Bombeiros, etc.
- com a orientação inter-hospitalar: equipas de diferentes hospitais, CODU, etc.
- com a equipe de trabalho hospitalar: imagiologia, bloco, laboratório, cuidados intensivos, etc.
Por fim, a reabilitação. O objectivo final deste empreendimento não deve ser, em exclusivo, manter o doente vivo. Isso não é suficiente. Devemos pugnar por devolver o indivíduo vitima de trauma plenamente apto para o regresso à vida em sociedade. Viver e ser produtivo. Muitas vezes, para familiares e próximos, a sobrevida é a principal preocupação. Para a sociedade em geral isso não chega. Os encargos com doentes incapacitados é elevado e custa a todos nós. Se for possível recuperá-los, torná-los úteis de novo, esse deve ser o objectivo. Evidentemente que esse objectivo deve ser cumprido de forma progressiva, passo a passo. Mas deve estar no horizonte desde o primeiro dia. A recuperação do doente pode ser dividida em 3 processos distintos: a recuperação anatómica, com auxilio da cirurgia nas suas diversas vertentes, a funcional, com apoio dos centros de reabilitação física e também a psicológica, em programas de apoio psiquiátrico e psicológico. O apoio psiquiátrico assume um papel importante, quer do ponto de vista preventivo, na recuperação dos doentes alcoólicos, por exemplo, quer terapêutico, já que muitos destes doentes vêem a sofrer de psicopatologia, alguns na forma de síndrome de stress pós-trauma, que os incapacita para o resto das suas vidas.
Haverá, com certeza, inúmeros aspectos ligados ao trauma e aos cuidados integrados que não foram aqui referidos. É um tema vasto e em constante evolução. Em Portugal a sua aplicabilidade está dependente de factores ligados à gestão e à administração, difíceis de ultrapassar apesar dos esforços realizados por muitos profissionais de saúde empenhados na mudança. O trauma, felizmente, não é uma epidemia no nosso país e temos lidado com as situações com qualidade. Mas há lugar para melhorar. E é para as situações menos frequentes que é mais necessário haver protocolos de actuação, para que quando surjam, nada falhe...
segunda-feira, 11 de julho de 2016
Subscrever:
Comentários (Atom)



