domingo, 5 de março de 2017
Capítulo 14: Separação Posterior de Componentes
Este não é bem um tema de urgência, mas achei interessante falar sobre ele, até porque será tema de um curso pré-congresso do XXXVII Congresso Nacional de Cirurgia e este texto pode servir de apoio à "aula" que aí vou apresentar.
No disease of the human body, belonging to the province of the surgeon, requires in its treatment a better combination of accurate anatomical knowledge, with surgical skill, than hernia in all its variety.
Astley Paston Cooper, 1768-1841
Na actualidade, a hérnia incisional representa um problema de saúde importante, complicando entre 11 a 23% de todas as laparotomias. Pior ainda, é o facto de que muitas delas irão recidivar. Entre 25 a 54% das hérnias reparadas sem prótese irão recidivar no prazo de um ano, e até 32% se forem reparadas com algum tipo de prótese.
A história natural da hérnia incisional tem também sofrido modificações ao longo do tempo. A emergência de técnicas cirúrgicas baseadas na cirurgia de controlo de danos, levou ao aparecimento de doentes em que o encerramento primário é impossível, originando um conjunto hérnias ventrais programadas que representam um sério problema cirúrgico.
Apesar do aparecimento de redes e próteses cada vez maiores e mais seguras, permitindo a reparação por via laparoscópica de grandes defeitos, alguns autores sempre entenderam que os grandes defeitos da parede abdominal necessitam de uma reparação mais fisiológica. Nesse sentido, a reparação de Rives-Stoppa terá sido a primeira a surgir, nos anos 1970, aproveitando o espaço retromuscular, posterior ao grande recto abdominal, para reforçar com prótese a reparação da linha média. Em 1990, Oscar Ramirez descreveu a separação anterior de componentes, aliando a secção do grande obliquo ao longo da linha semilunar à separação e abertura do espaço entre o grande e o pequeno obliquo. O conceito baseava-se na necessidade de produzir um avanço mio-fascial com aproximação das estruturas à linha média, permitindo uma reparação funcional da parede abdominal. Porém, a técnica de Rives-Stoppa não permite a sua aplicação quando o defeito é muito grande e a técnica de Ramirez obriga a um descolamento cutâneo extenso, com secção dos vasos nutritivos, produzindo, com frequência, a necrose do retalho.
 |
| Laparoplastia de Rives-Stoppa Imagem: https://es.slideshare.net/ivojvodic2000/cirugia-de-eventraciones-gigantes |
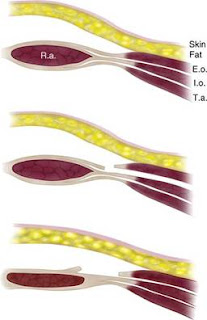 |
| Separação anterior de componentes segundo Ramirez Imagem: http://drkevinbrenner.com/uncategorized/reconstruction-massive-abdominal-hernias/ |
Como sabemos, as hérnias incisionais apresentam, frequentemente, defeitos volumosos ou múltiplos. O "bulging" que produzem na parede abdominal pode ser tão importante que, além do defeito funcional, é um estorvo fisico para os doentes, obrigando-os a usar algum tipo de contenção. A colocação de uma prótese sub-peritoneal, como se faz em laparoscopia, pode evitar o movimento visceral e o encarceramento, mas o defeito funcional e fisico permanecem. Não me parece que seja uma solução adequada, sobretudo para defeitos de grande volume. É necessária uma reparação da linha branca... Em 2004 a American Hernia Society considerou as técnicas de avanço mio-fascial como gold standard no tratamento de hérnias incisionais por via aberta.
Nos anos 2010 começou a surgir uma nova técnica, utilizada de forma um pouco inconsistente por vários autores, mas definida e publicada por Michael Rosen em 2012. Trata-se da separação posterior de componentes. A Separação Posterior de Componentes vem afirmar-se como um método alternativo para reparação de grandes defeitos da parede abdominal, podendo ser usada em quase todos os casos. Preserva a inervação do músculo grande recto e a vascularização muscular e da pele e tecido celular subcutâneo, reconstruindo a linha branca, contribuindo assim quer para uma reparação funcional, quer para redução das complicações ligadas à necrose do retalho.
A técnica pode resumir-se nos seguintes passos:
1. Adesiólise: Após a abertura ampla da cavidade abdominal, sem remoção de pele ou de saco (irão perceber porquê), as aderências entre as ansas e a parede devem ser cuidadosamente desfeitas. Além de permitir uma melhor aproximação à linha média do saco visceral, evita a lesão das ansas durante o descolamento do peritoneu/fascia transversalis do músculo transverso do abdomen.
2. Abertura da bainha posterior do recto: Esta manobra é iniciada, em regra, junto ao umbigo e cerca de 5 mm dentro e posterior ao bordo do defeito herniário. A secção levará à exposição do bordo medial do músculo grande recto do abdómen e será alargada em sentido cranial e caudal.
3. Desenvolvimento de plano retromuscular: Descolamento do músculo grande recto de abdomen da aponevrose da bainha posterior. Esta dissecção deve ser feita com o cuidado para preservação do vasos epigástricos que percorrem o músculo longitudinalmente e o rolo nervoso que penetra no grande recto do abdomen atravessando a bainha posterior. A preservação destas estruturas é fundamental para os bons resultados da técnica.
4. Abertura da bainha posterior do grande recto e secção do músculo transverso do abdómen: Iniciando na sua extremidade superior, onde o músculo transverso se estende mais para dentro, a bainha posterior é seccionada, acedendo ao músculo transverso que é seccionado em conjunto. Nesta manobra há que ter cuidado com os componentes vasculo-nervosos, pelo que deve efectuar-se ligeiramente medial à linha semilunar, e até à fascia endo-abdominal, que não deve ultrapassar-se. Deve colocar-se o plano de dissecção posterior ao músculo transverso e entre este e a fascia endo-abdominal.
 |
| Abertura da bainha posterior do grande recto abdominal Imagem: Atlas of Abdominal Wall Reconstruction. Rosen MJ ed. Philadelphia, PA; Elsevier; 2011. |
5. Desenvolvimento do espaço entre o transverso do abdómen e a fascia endo-abdominal bilateralmente: Este descolamento é executado por dissecção romba. Trata-se de um espaço avascular que pode ser estendido, lateralmente até ao quadrado dos lombos, para acomodar a prótese. Qualquer orifício no peritoneu deve ser reparado. Se não for possível o seu encerramento primário, pode usar-se o epíploon ou um pedaço de rede absorvível (Vycril).
6. Desenvolvimento do espaço sub-xifoideu e retro-púbico: Continuando o descolamento a nível superior e inferior, abrem-se os espaços de Retzius, em baixo, expondo o ligamento de Cooper, e o apêndice xifóide, em cima. É importante que este espaço seja amplo para acomodar a prótese, que deverá exceder o defeito da hérnia. A distância de sobreposição da prótese não é consensual, mas o valor mais referido é de 8 a 10 cm.
7. Encerramento na linha média do "envelope" visceral: O "envelope" constituído pela fascia endo-abdominal e peritoneu, reforçado na linha média pela bainha posterior dos rectos, é aproximada na linha média e suturada. Raras vezes não será possível encerrar esse defeito. Se assim for, poderão usar-se restos do saco herniário para o efeito.
8. Colocação da rede no espaço pré-peritoneal: A rede deve ser colocada neste espaço dissecado, com as medidas ajustadas ao tamanho do defeito. A fixação deverá ser efectuada com fio não absorvível, com 2 pontos a nível do ligamento de Cooper (um em cada lado), dois pontos sub-xifoideus e 4 pontos de cada lado, trans-aponevróticos. Este últimos poderão necessitar pequenas incisões cutâneas para poder dar os nós, após passagem com agulha de Reverdin através da parede lateral músculo-aponevrótica.
9. Encerramento da linha média: O bordo interno da bainha dos rectos é aproximada com fio não absorvível após a colocação de drenagem aspirativa na loca onde repousa a prótese e sobre esta. Habitualmente utilizam-se dois drenos com aspiração activa, um em cada lado. Por vezes, a aproximação da linha média não é possível, pelo que o defeito terá de ser completado por prótese, também. A escolha recai sobre uma prótese de polipropileno simples, que deverá ser coberta com tecido celular subcutâneo durante o encerramento da pele. Só agora iremos verificar se é necessário remover pele e qual a quantidade a remover para não ficar "sem pano".
Aconselho a não operar doentes obesos ou fumadores. Os resultados são maus para estes doentes, com todas as técnicas. Assim, um doente com IMC superior a 40 deve ser aconselhado a emagrecer. Um doente fumador deveria para de fumar 4 semanas antes de ser operado. É evidente que estes são objectivos algo irreais, mas operar um doente com uma grande hérnia incisional que mantém hábitos tabágicos ou com IMC elevado é arriscar não só uma recorrência, mas complicações pós-operatórias graves.
A prótese a usar deve ser não reabsorvível. Uma vez que é colocado num espaço que não estará em contacto com vísceras, a utilização de uma malha de polipropileno simples parece-me adequada. Na presença de infecção ou contaminação, como é o caso em que se tem de manipular estomias, a utilização de uma prótese biológica pode estar indicada. Ultimamente tenho utilizado uma prótese auto-colante, sem fixação (Adhesix Bard). Os resultados são bons, aparentemente, e permite reduzir um pouco o tempo operatório, que anda à volta das 4 horas... em média.
Uma nota sobre o período pós-operatório. A analgesia é de vital importância e a utilização de epidural é aconselhada de forma sistemática. O início precoce, e mesmo pré-operatório, de cinesiterapia respiratória é crucial. Esta técnica cirúrgica cria um espartilho que pode perturbar a função respiratória e este facto deve ser previsto. A elevação da pressão de pico inspiratório durante o encerramento da aponevrose pode indicar a necessidade de permanência do doente sob ventilação assistida e ser desmamado com mais tempo, em UCIP, no decurso de 24 a 48 horas.
Os resultados desta técnica são bons. Segundo os estudos do próprios Michael Rosen, a taxa de recidiva anda à volta dos 5%. São resultados muito encorajadores, mas o que sobressai mais é a redução da taxa de infecções pós-cirúrgicas relativamente às outras técnicas de avanço mio-fascial, particularmente à técnica de Ramirez. Esta última, em vários estudos, reporta-se uma taxa de infecção entre 26 e 42%, condicionada pela isquémia dos retalhos cutâneos. Num dos seus primeiros trabalhos, após 42 hernioplastias, Michael Rosen verificou uma taxa de 7% de infecções da ferida operatória grave. Num estudo comparativo entre a técnica de separação anterior e a posterior de componentes, o mesmo autor reporta taxas de 48,2% e 25,5% de complicações da ferida operatória, respectivamente.
Em conclusão: trata-se de situações complexas que necessitam, para a sua abordagem, uma técnica que seja inteligente e resolva os problemas do doente. Isso significa que, mais do que tapar o orifício, é preciso oferecer ao doente uma reparação que restaure a funcionalidade da parede abdominal. Isso só é possível através das técnicas de aproximação mio-fascial com reconstrução da linha média, reforçada por uma prótese. No caso da Separação Posterior de Componentes, a prótese é colocada num espaço virtual, pré-peritoneal, longe do contacto com as vísceras e longe da superfície.
Are you sure you are the best person for the job?
Francis D. Moore
sábado, 4 de fevereiro de 2017
Capítulo 13: Isquémia mesentérica aguda
A isquémia mesentérica aguda foi alvo recente de uma publicação de guidelines em que tive o prazer de participar. Podem aceder ao artigo completo em http://link.springer.com/article/10.1007/s00068-016-0634-0.
Vou discutir neste texto apenas alguns aspectos mais práticos.
“Occlusion of the mesenteric vessels is regarded as one of those conditions in which the diagnosis is impossible, the prognosis hopeless, and the treatment almost useless”.
Esta frase, proferida por Cokkinis há mais de 70 anos atrás, revela um pessimismo que ainda hoje prevalece, quando falamos de isquémia mesentérica aguda (AMI). Para esta opinião contribui o mau prognóstico destes doentes, que se tem mantido ao longo de décadas, apesar da evolução técnica e cientifica da Medicina, em geral e da Cirurgia em particular.
A AMI constitui menos de 1% do total dos quadros de abdómen agudo que se apresentam nos Serviços de Urgência, mas cerca de 10% se os doentes tiverem idade superior a 70 anos. A mortalidade é elevada, entre 60 a 80%, sobretudo devido ao atraso diagnóstico.
A AMI pode ser dividida em 4 classes distintas:
- EAMI - embólica, a mais frequente, com origem habitual num êmbolo formado no coração.
- TAMI - trombótica, resultante da trombose de uma placa aterosclerótica na artéria mesentérica, habitualmente na sua origem.
Estas duas classes podem ser classificadas como AMI arterial oclusiva.
- VAMI - a trombose venosa, habitual numa população mais jovem e associada, frequentemente, a discrasias da coagulação.
- NOMI - a AMI não oclusiva, típica dos doentes críticos, habitualmente internados em Unidades de Cuidados Intensivos.
A doença arterial oclusiva é, de longe a mais comum. Os doentes são habitualmente idosos e portadores de patologia cardiovascular prévia, por vezes bem conhecida. A presença de arritmia cardíaca, principalmente fibrilhação auricular, sugere uma origem embólica. O inicio súbito da dor seguido de um intervalo livre de dor de duração variável (6 a 12 horas) é muito característico da oclusão embólica. A doença oclusiva trombótica tem uma apresentação mais insidiosa e por vezes, precedida de sintomas típicos de angor abdominal.
A doença venosa surge num contexto distinto. Os doentes são mais jovens, por vezes na década de 40. A associação com situações pré-trombóticas é muito frequente e entre estas o factor V de Leyden é o mais vezes encontrado. No entanto, não é de descartar a possibilidade de síndrome paraneoplásica, sobretudo de neoplasias primitivas do fígado e do pâncreas. As queixas são inespecíficas e com frequência de longa duração (vários dias ou semanas) e a sua evolução depende da extensão de delgado envolvido.
A doença não oclusiva é característica de doentes críticos. Doentes com sépsis, disfunção orgânica múltipla ou sob aminas são os mais típicos. Hemodiálise e pós-operatório de cirurgia cardíaca são outras condições que podem surgir associadas. Com o doente ventilado e entubado, as queixas clínicas são de pouco valor para levantar suspeita. Por vezes são o aparecimento súbito de distensão abdominal ou o agravamento dos parâmetros inflamatórios os primeiros indicadores da possibilidade de NOMI.
O primeiro passo para chegar ao diagnóstico é, efectivamente, a suspeita. Pensar na possibilidade de AMI é imprescindível para iniciar todo a investigação que leva a um diagnóstico precoce e a uma possibilidade de tratamento. Neste contexto, a suspeita pode ser, também, o melhor factor de bom prognóstico a favor do doente. Na presença de um doente com queixas abdominais inespecíficas, com idade e patologia associada favorável, a AMI deve fazer parte do diagnóstico diferencial inicial. O atraso diagnóstico é factor de prognóstico que mais influencia a sobrevida.
A suspeita deve levar à realização imediata de uma angioTC abdominal.
São várias as questões que se colocam relativamente à realização deste exame, porém, é apenas com ele que se podem tomar decisões relativas à subsequente atitude terapêutica. A presença de um doente com alguma instabilidade, por vezes com lesão renal aguda ou sem jejum, pode atrasar a realização da TC. No entanto, esta é uma das circunstâncias em que deverá ser realizada com a maior brevidade, sobretudo no doente que se apresenta com um quadro clínico sugestivo (dor abdominal, idade superior a 70 anos, patologia cardíaca...). Não existe nenhum outro meio diagnóstico que nos possa fornecer os dados que uma TC bem efectuada fornece. Já foram pesquisados imensos marcadores biológicos (e nós continuamos a procurar respostas na LDH, d-dimeros e lactatos, certo?) mas nenhum deles é sensível o suficiente para produzir alterações que nos conduzam ao diagnóstico em tempo útil.
Depois de conseguido um diagnóstico adequado, o doente necessita de uma ressuscitação adequada que passa pela administração de fluidos (cristalóides, quase sempre), correcção da acidose, administração de antibiótico de largo espectro e anticoagulação sistémica. A maioria destes doentes terão ser submetidos a algum tipo de intervenção para desobstrução vascular. Excluem-se os casos de trombose venosa, em que a anticoagulação pode ser suficiente e os doentes com NOMI...
Actualmente, no tratamento da doença oclusiva, podemos considerar que o Gold Standard é a angiografia e os procedimentos por via percutânea. É possível, por via endovascular, reparar estenoses da artéria mesentérica superior e mesmo remover trombos e êmbolos no seu interior. Há que salvaguardar os casos em que há sinais de irritação peritoneal ou outra evidência da existência de sofrimento irreversível das ansas intestinais, indicando, formalmente, a sua ressecção. Nestes casos, além do procedimento de revascularização, é necessária a laparotomia para remoção do tecido necrosado.
Porém, a logística necessária para estes procedimentos não está disponível em todos os Hospitais e, nestes casos, tempo é dinheiro. Assim, poderá ser necessária a abordagem primária cirúrgica para restabelecimento da continuidade vascular. Em casos de ausência de sinais que indiquem uma exploração urgente por peritonite, é aceitável a transferência do doente para um Hospital com meios imagiológicos de intervenção, caso a transferência se possa fazer de forma expedita. Nos restante casos, o Cirurgião Geral ou o Cirurgião Vascular, terão de abordar o doente com uma estratégia de revascularização em mente, além da possibilidade de ressecção intestinal. No caso da EAMI, a embolectomia da artéria mesentérica superior é, em regra, suficiente. Após um controlo proximal e distal da artéria, com dissecção cuidada, a "Fogartização" proximal e distal com verificação de retoma de fluxo é a manobra adequada. Classicamente, nestas circunstâncias, a arteriotomia deve ser transversal, permitindo o acesso ao lúmen e prevenindo o estreitamento aquando do seu encerramento (Prolene 4 ou 5/0). Já no caso da TAMI, deveremos "Fogartizar" de igual forma, mas a arteriotomia deverá ser longitudinal, preparando-a para a pontagem, necessária nestes casos, se se pretende ter resultados duradouros. A pontagem, ou bypass, como se gosta actualmente de dizer, assume-se como o tratamento definitivo da doença arterial obstrutiva e pode ser efectuada com prótese ou veia, directamente à aorta ou, mais facilmente, à artéria ilíaca esquerda. Apesar da prótese produzir melhores resultados mas devemos lembrar que se trata, muitas vezes, de território infectado que poderá contra-indicar a utilização de material estranho. Seguem-se a estas intervenções, as ressecções intestinais necessárias. É habitual anticoagular os doentes e mesmo administrar heparina sódica intra-arterial aquando do restabelecimento do fluxo, em sentido anterógrado.
Na sequência de uma laparotomia por isquémia mesentérica arterial coloca-se sempre a questão do second-look. Este procedimento deverá ser realizado sempre que haja dúvidas sobre a viabilidade das ansas intestinais após um tratamento cirúrgico com intenção curativa. Poderá ser realizado "on demand" ou programado e em contexto de controlo de dano ou não. Actualmente, considera-se mais conveniente a realização inicial de uma cirurgia de controlo de dano, com remoção das ansas isquémicas, encerramento dos topos e revisão posterior com confecção das anastomoses. Não existe apoio cientifico para este tipo de atitude, mas tem-se verificado que os resultados são aceitáveis, assim como para a generalidade da atitude de controlo de dano noutras circunstâncias. As anastomoses devem ser evitadas quando o doente se apresenta instável do ponto de vista hemodinâmico e metabólico, devendo optar-se, nestes casos, pelo controlo de danos. A segunda visita deverá ser realizada pelas 48 horas. Os estudos demonstram que para lá desse tempo aumenta a taxa de infecção e de incapacidade de encerrar o abdómen primariamente. Se realizada antes, ainda não houve tempo suficiente para que se desenvolvam os sinais de isquémia intestinal que irão decidir qual o limite da ressecção.
O tratamento da trombose mesentérica venosa passa pela anticoagulação sistémica com heparina de baixo peso molecular, substituída por um dicumarínico logo que possível. Alguns centros Americanos têm utilizado NOACs no tratamento desta situação. Se bem que a literatura e as guidelines sobre estes fármacos são omissas relativamente a esta patologia em particular, a realidade é que considerando-a como doença tromboembólica ela cai nas indicações actualmente aceites para a administração destes fármacos. Atender ao facto que, no caso dos dicumarínicos, estes interferem com os resultados analíticos na pesquisa de trombofilia,(por exemplo, proteínas C e S) pelo que só devem ser iniciados após colheita de amostra para o laboratório. De igual modo à isquémia arterial, a presença de sinais de irritação peritoneal ou de perfuração de víscera oca, deverá levar a laparotomia imediata. A maioria das vezes, o que se encontra é um segmento de delgado de aspecto edemaciado e vinoso, cuja viabilidade é, quase sempre, duvidosa e difícil de esclarecer, levando quase sempre à sua ressecção.
A NOMI é bem mais complexa. Quer na sua etiopatogenia quer no seu tratamento. Habitualmente associada a situações criticas com instabilidade hemodinâmica e utilização de aminas, ou a pós-operatório de cirurgias major, habitualmente cardíaca ou vascular, testemunha uma isquémia distal do território esplâncnico provocada défice de volume ou vasoconstrição extrema deste território vascular. A sua resolução passa pelo tratamento das condições de base que levaram a esse estado de défice perfusional e, a maioria das vezes, a ressecção dos segmentos intestinais, habitualmente delgado, atingidos. A mortalidade é muito alta, devido ao mau estado dos doentes e também à necessidade de ressecções muito amplas.
A forma como olhamos para a isquémia mesentérica poderá modificar-se nos próximos tempos. Em grande medida, o prognóstico está ligado à rapidez com que se chega ao diagnóstico. Essa precocidade, agora dependente do índice de suspeição do Médico que observa o doente, poderá ser dependente, no futuro próximo,de uma análise laboratorial especifica e barata. Vários grupos têm investigado o poder discriminativo de marcadores de necrose intestinal, componentes da mucosa digestiva. Infelizmente, a aplicação prática de uma descoberta como esta, parece ainda distante, dado que os vários marcadores testados não se têm mostrado particularmente específicos da AMI,apesar da sua elevada sensibilidade. Vamos ter de esperar. Até lá, temos de pensar neste diagnóstico como uma possibilidade em todos os doentes incluídos nos de risco.
Não se esqueçam de dar uma olhadela ao artigo das Guidelines que está disponível on line.
Vou discutir neste texto apenas alguns aspectos mais práticos.
“Occlusion of the mesenteric vessels is regarded as one of those conditions in which the diagnosis is impossible, the prognosis hopeless, and the treatment almost useless”.
Esta frase, proferida por Cokkinis há mais de 70 anos atrás, revela um pessimismo que ainda hoje prevalece, quando falamos de isquémia mesentérica aguda (AMI). Para esta opinião contribui o mau prognóstico destes doentes, que se tem mantido ao longo de décadas, apesar da evolução técnica e cientifica da Medicina, em geral e da Cirurgia em particular.
A AMI constitui menos de 1% do total dos quadros de abdómen agudo que se apresentam nos Serviços de Urgência, mas cerca de 10% se os doentes tiverem idade superior a 70 anos. A mortalidade é elevada, entre 60 a 80%, sobretudo devido ao atraso diagnóstico.
A AMI pode ser dividida em 4 classes distintas:
- EAMI - embólica, a mais frequente, com origem habitual num êmbolo formado no coração.
- TAMI - trombótica, resultante da trombose de uma placa aterosclerótica na artéria mesentérica, habitualmente na sua origem.
Estas duas classes podem ser classificadas como AMI arterial oclusiva.
- VAMI - a trombose venosa, habitual numa população mais jovem e associada, frequentemente, a discrasias da coagulação.
- NOMI - a AMI não oclusiva, típica dos doentes críticos, habitualmente internados em Unidades de Cuidados Intensivos.
A doença arterial oclusiva é, de longe a mais comum. Os doentes são habitualmente idosos e portadores de patologia cardiovascular prévia, por vezes bem conhecida. A presença de arritmia cardíaca, principalmente fibrilhação auricular, sugere uma origem embólica. O inicio súbito da dor seguido de um intervalo livre de dor de duração variável (6 a 12 horas) é muito característico da oclusão embólica. A doença oclusiva trombótica tem uma apresentação mais insidiosa e por vezes, precedida de sintomas típicos de angor abdominal.
A doença venosa surge num contexto distinto. Os doentes são mais jovens, por vezes na década de 40. A associação com situações pré-trombóticas é muito frequente e entre estas o factor V de Leyden é o mais vezes encontrado. No entanto, não é de descartar a possibilidade de síndrome paraneoplásica, sobretudo de neoplasias primitivas do fígado e do pâncreas. As queixas são inespecíficas e com frequência de longa duração (vários dias ou semanas) e a sua evolução depende da extensão de delgado envolvido.
A doença não oclusiva é característica de doentes críticos. Doentes com sépsis, disfunção orgânica múltipla ou sob aminas são os mais típicos. Hemodiálise e pós-operatório de cirurgia cardíaca são outras condições que podem surgir associadas. Com o doente ventilado e entubado, as queixas clínicas são de pouco valor para levantar suspeita. Por vezes são o aparecimento súbito de distensão abdominal ou o agravamento dos parâmetros inflamatórios os primeiros indicadores da possibilidade de NOMI.
O primeiro passo para chegar ao diagnóstico é, efectivamente, a suspeita. Pensar na possibilidade de AMI é imprescindível para iniciar todo a investigação que leva a um diagnóstico precoce e a uma possibilidade de tratamento. Neste contexto, a suspeita pode ser, também, o melhor factor de bom prognóstico a favor do doente. Na presença de um doente com queixas abdominais inespecíficas, com idade e patologia associada favorável, a AMI deve fazer parte do diagnóstico diferencial inicial. O atraso diagnóstico é factor de prognóstico que mais influencia a sobrevida.
A suspeita deve levar à realização imediata de uma angioTC abdominal.
São várias as questões que se colocam relativamente à realização deste exame, porém, é apenas com ele que se podem tomar decisões relativas à subsequente atitude terapêutica. A presença de um doente com alguma instabilidade, por vezes com lesão renal aguda ou sem jejum, pode atrasar a realização da TC. No entanto, esta é uma das circunstâncias em que deverá ser realizada com a maior brevidade, sobretudo no doente que se apresenta com um quadro clínico sugestivo (dor abdominal, idade superior a 70 anos, patologia cardíaca...). Não existe nenhum outro meio diagnóstico que nos possa fornecer os dados que uma TC bem efectuada fornece. Já foram pesquisados imensos marcadores biológicos (e nós continuamos a procurar respostas na LDH, d-dimeros e lactatos, certo?) mas nenhum deles é sensível o suficiente para produzir alterações que nos conduzam ao diagnóstico em tempo útil.
Depois de conseguido um diagnóstico adequado, o doente necessita de uma ressuscitação adequada que passa pela administração de fluidos (cristalóides, quase sempre), correcção da acidose, administração de antibiótico de largo espectro e anticoagulação sistémica. A maioria destes doentes terão ser submetidos a algum tipo de intervenção para desobstrução vascular. Excluem-se os casos de trombose venosa, em que a anticoagulação pode ser suficiente e os doentes com NOMI...
Actualmente, no tratamento da doença oclusiva, podemos considerar que o Gold Standard é a angiografia e os procedimentos por via percutânea. É possível, por via endovascular, reparar estenoses da artéria mesentérica superior e mesmo remover trombos e êmbolos no seu interior. Há que salvaguardar os casos em que há sinais de irritação peritoneal ou outra evidência da existência de sofrimento irreversível das ansas intestinais, indicando, formalmente, a sua ressecção. Nestes casos, além do procedimento de revascularização, é necessária a laparotomia para remoção do tecido necrosado.
Porém, a logística necessária para estes procedimentos não está disponível em todos os Hospitais e, nestes casos, tempo é dinheiro. Assim, poderá ser necessária a abordagem primária cirúrgica para restabelecimento da continuidade vascular. Em casos de ausência de sinais que indiquem uma exploração urgente por peritonite, é aceitável a transferência do doente para um Hospital com meios imagiológicos de intervenção, caso a transferência se possa fazer de forma expedita. Nos restante casos, o Cirurgião Geral ou o Cirurgião Vascular, terão de abordar o doente com uma estratégia de revascularização em mente, além da possibilidade de ressecção intestinal. No caso da EAMI, a embolectomia da artéria mesentérica superior é, em regra, suficiente. Após um controlo proximal e distal da artéria, com dissecção cuidada, a "Fogartização" proximal e distal com verificação de retoma de fluxo é a manobra adequada. Classicamente, nestas circunstâncias, a arteriotomia deve ser transversal, permitindo o acesso ao lúmen e prevenindo o estreitamento aquando do seu encerramento (Prolene 4 ou 5/0). Já no caso da TAMI, deveremos "Fogartizar" de igual forma, mas a arteriotomia deverá ser longitudinal, preparando-a para a pontagem, necessária nestes casos, se se pretende ter resultados duradouros. A pontagem, ou bypass, como se gosta actualmente de dizer, assume-se como o tratamento definitivo da doença arterial obstrutiva e pode ser efectuada com prótese ou veia, directamente à aorta ou, mais facilmente, à artéria ilíaca esquerda. Apesar da prótese produzir melhores resultados mas devemos lembrar que se trata, muitas vezes, de território infectado que poderá contra-indicar a utilização de material estranho. Seguem-se a estas intervenções, as ressecções intestinais necessárias. É habitual anticoagular os doentes e mesmo administrar heparina sódica intra-arterial aquando do restabelecimento do fluxo, em sentido anterógrado.
Na sequência de uma laparotomia por isquémia mesentérica arterial coloca-se sempre a questão do second-look. Este procedimento deverá ser realizado sempre que haja dúvidas sobre a viabilidade das ansas intestinais após um tratamento cirúrgico com intenção curativa. Poderá ser realizado "on demand" ou programado e em contexto de controlo de dano ou não. Actualmente, considera-se mais conveniente a realização inicial de uma cirurgia de controlo de dano, com remoção das ansas isquémicas, encerramento dos topos e revisão posterior com confecção das anastomoses. Não existe apoio cientifico para este tipo de atitude, mas tem-se verificado que os resultados são aceitáveis, assim como para a generalidade da atitude de controlo de dano noutras circunstâncias. As anastomoses devem ser evitadas quando o doente se apresenta instável do ponto de vista hemodinâmico e metabólico, devendo optar-se, nestes casos, pelo controlo de danos. A segunda visita deverá ser realizada pelas 48 horas. Os estudos demonstram que para lá desse tempo aumenta a taxa de infecção e de incapacidade de encerrar o abdómen primariamente. Se realizada antes, ainda não houve tempo suficiente para que se desenvolvam os sinais de isquémia intestinal que irão decidir qual o limite da ressecção.
O tratamento da trombose mesentérica venosa passa pela anticoagulação sistémica com heparina de baixo peso molecular, substituída por um dicumarínico logo que possível. Alguns centros Americanos têm utilizado NOACs no tratamento desta situação. Se bem que a literatura e as guidelines sobre estes fármacos são omissas relativamente a esta patologia em particular, a realidade é que considerando-a como doença tromboembólica ela cai nas indicações actualmente aceites para a administração destes fármacos. Atender ao facto que, no caso dos dicumarínicos, estes interferem com os resultados analíticos na pesquisa de trombofilia,(por exemplo, proteínas C e S) pelo que só devem ser iniciados após colheita de amostra para o laboratório. De igual modo à isquémia arterial, a presença de sinais de irritação peritoneal ou de perfuração de víscera oca, deverá levar a laparotomia imediata. A maioria das vezes, o que se encontra é um segmento de delgado de aspecto edemaciado e vinoso, cuja viabilidade é, quase sempre, duvidosa e difícil de esclarecer, levando quase sempre à sua ressecção.
A NOMI é bem mais complexa. Quer na sua etiopatogenia quer no seu tratamento. Habitualmente associada a situações criticas com instabilidade hemodinâmica e utilização de aminas, ou a pós-operatório de cirurgias major, habitualmente cardíaca ou vascular, testemunha uma isquémia distal do território esplâncnico provocada défice de volume ou vasoconstrição extrema deste território vascular. A sua resolução passa pelo tratamento das condições de base que levaram a esse estado de défice perfusional e, a maioria das vezes, a ressecção dos segmentos intestinais, habitualmente delgado, atingidos. A mortalidade é muito alta, devido ao mau estado dos doentes e também à necessidade de ressecções muito amplas.
A forma como olhamos para a isquémia mesentérica poderá modificar-se nos próximos tempos. Em grande medida, o prognóstico está ligado à rapidez com que se chega ao diagnóstico. Essa precocidade, agora dependente do índice de suspeição do Médico que observa o doente, poderá ser dependente, no futuro próximo,de uma análise laboratorial especifica e barata. Vários grupos têm investigado o poder discriminativo de marcadores de necrose intestinal, componentes da mucosa digestiva. Infelizmente, a aplicação prática de uma descoberta como esta, parece ainda distante, dado que os vários marcadores testados não se têm mostrado particularmente específicos da AMI,apesar da sua elevada sensibilidade. Vamos ter de esperar. Até lá, temos de pensar neste diagnóstico como uma possibilidade em todos os doentes incluídos nos de risco.
Não se esqueçam de dar uma olhadela ao artigo das Guidelines que está disponível on line.
Subscrever:
Mensagens (Atom)

